Количественными характеристиками буферных растворов являются рН буферного раствора и буферная емкость.
Выведем уравнение для расчета рН на примере ацетатной буферной системы. В растворе рассматриваемой буферной системы протекают процессы:
CH3COOH + H2O ↔ CH3COO– + Н3О+;
CH3COONa → CH3COO– + Na+.
Концентрацию ионов водорода данной буферной смеси можно определить из уравнения константы диссоциации слабого электролита:
 откуда [H+] = Ka
откуда [H+] = Ka 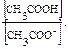 ?
?
Присутствие в растворе соли, которая является источником ацетат-анионов, подавляет диссоциацию слабой кислоты. В этом случае уксусная кислота присутствует в растворе в молекулярной форме и равновесная концентрация кислоты близка к ее исходной концентрации. Основным источником ацетат-анионов в растворе является соль. Принимая во внимание эти условия, можно записать:
[H+] = Ka 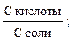
рН = –lgKa – lg 
–lgKa = рКа;
рН = рКа – lg 
Из уравнения следует, что рН кислотного буферного раствора определяется значением Ка кислоты и концентрациями кислоты и соли.
Концентрации компонентов буферной смеси могут быть выражены разными способами: молярной концентрацией, молярной концентрацией эквивалента, количеством вещества, количеством эквивалента вещества.
Для основной буферной системы:
[OH–] = Kв 
рОН = рКв –lg 
рН = 14 – рОН = 14 – рКв + lg 
рН основного буферного раствора определяется значением Кв
основания и концентрациями основания и соли.
Способность буферных растворов сохранять определенное значение рН при добавлении сильной кислоты или щелочи зависит от состава буферной смеси и концентрации ее компонентов.
Для количественной характеристики этой сопротивляемости буферных растворов к добавлению сильных кислот и оснований введено понятие буферная емкость.
 2020-06-08
2020-06-08 361
361








