Растворы слабых электролитов характеризуются двумя величинами: степенью диссоциации (α), которая показывает долю распавшихся молекул, и константной диссоциации (Кдис). Константа диссоциации есть не что иное, как константа равновесия для реакции диссоциации. Константа диссоциации определяет глубину протекания процесса диссоциации, чем меньше Кдис, тем слабее электролит. Согласно закону разбавления Оствальда эти величины связаны соотношением:
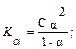 при α << 1 формулу можно упростить Кдис
при α << 1 формулу можно упростить Кдис 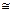 α2С.
α2С.
Пример 1. Вычислите рН 0,02 М раствора сероводородной кислоты.
Решение: Двухосновная слабая кислота диссоциирует в две ступени:
H2S ↔ H+ + HS–; HS– ↔ H+ + S2–,
каждой из которых отвечает своя константа диссоциации:
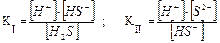
По данным справочной литературы,
Кl (H2S) = 8,9 · 10–8, Kll (H2S) = 2,5 · 10–13
Так как Кl превышает Кll более чем в 1000 раз, то вычисляем [H+], учитывая только первую ступень диссоциации. Примем концентрацию ионов водорода за х и учтем, согласно уравнению диссоциации сероводородной кислоты по I ступени, что концентрация [H+] = [HS–] = х, а равновесная концентрация недиссоциированных молекул
[H2S] = CH2S – x ≈ CH2S.
Тогда 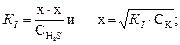
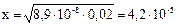 моль/л;
моль/л;
отсюда рН = –lg 4,2 · 10–5 = 4,34.
Пример 2. Вычислите рН 0,001 М раствора аммиака
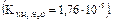 .
.
Решение: В водном растворе аммиака имеет место равновесие
NH3 · H2O ↔ NH4+ + OH–;
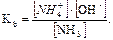
Так как 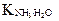 < 10–4, то равновесная концентрация недиссоциированных молекул аммиака практически равна его общей концентрации [NH3] = 0,001 моль/л.
< 10–4, то равновесная концентрация недиссоциированных молекул аммиака практически равна его общей концентрации [NH3] = 0,001 моль/л.
По аналогии с предыдущей задачей:
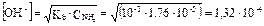 моль/л.
моль/л.
Из ионного произведения воды KW=[H+] · [OH–] = 1,01 · 10–14 находим концентрацию катионов водорода:
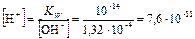 моль/л;
моль/л;
pH = –lg 7,6 · 10–11 = 10,10.
Пример 3. Какая масса азотистой кислоты содержится в 0,40 л раствора, имеющего рН = 3,00? (Ка = 4,6 · 10–4)
Решение: Так как рН = 3,00, то [H+] = 10–3 моль/л.
HNO2 ↔ H+ + NO2–.
Из закона разбавления Оствальда следует, что
[H+]2 = Ka · 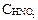
Отсюда 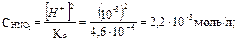 поскольку
поскольку
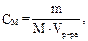
m(HNO2) = CM · M · Vр-ра = 2,2 10–3 · 47 · 0,40 = 4,14 · 10–2 г.
Контрольные вопросы
1. Почему шкала значений рН водных растворов кислот, оснований и других соединений находится в пределах от 0 до 14? Может ли рН водного раствора быть больше 14?
2. Назовите все ионы, которые присутствуют в водном растворе серной кислоты.
3. Расположите в ряд по возрастанию величины рН следующие растворы:
а. рН = 3,00;
b. pOH = 3,00;
c. [OH–] = 10–5 моль/л;
d. [H+] = 10–6 моль/л;
е. [H+] = [OH–].
4. При равной молярной концентрации растворы каких кислот будут иметь меньшее значение рН:
а) HCl или CH3COOH; b) HNO2 или HClO; c) HCl или HClO2?
5. Какой концентрации ионов водорода соответствуют значения рН: 3,00; 7,00; 10,00; 12,00?
6. Дайте определение степени диссоциации слабого электролита. Как степень диссоциации связана с константой диссоциации?
7. Как зависит степень диссоциации от концентрации электролита в растворе?
8. Напишите уравнения ступенчатой диссоциации Pb(OH)2 и H3PO4 и выражения для констант диссоциации по каждой из ступеней.
9. Катион Cr3+ и катион Fe3+ присутствуют в растворах с одинаковой ионной силой. Отличается ли активность этих ионов в растворах?
 2020-06-08
2020-06-08 122
122








