Методические рекомендации
По организации дистанционной работы
При решении задач по разделу: «Молекулярная физика. Термодинамика»
Методические рекомендации предназначены для организации самостоятельной внеаудиторной работы по учебному предмету «Физика» при решении задач по разделу: «Молекулярная физика. Термодинамика».
Методическое пособие включает в себя теоретический материал по разделу: «Молекулярная физика. Термодинамика», примеры решения задач типовых заданий по указанной тематике, задания для выполнения внеаудиторных работ по указанной тематике.
Предназначены для студентов первого курса среднего специального профессионального образования, обучающихся по специальностям технического профиля.
Введение
В соответствии с рабочими программами по дисциплине «Физика» мною составлены методические разработки на тему: «Организация самостоятельной работы при решении задач по разделу «Молекулярная физика. Термодинамика». Эти методические разработки явились своего рода опорными конспектами для студентов при организации самостоятельной работы. Программа изучения дисциплины «Физика» предусматривает, кроме обязательных часов аудиторной работы, также и определенный объем самостоятельной внеаудиторной работы. Эффективная самостоятельная работа способствует формированию и развитию общих и профессиональных компетенций студентов.
Самостоятельная внеаудиторная работа обучающегося – это вид деятельности, выступающий как специфическая форма учебного и научного познания, внутренним содержанием которого является самостоятельное построение обучающимся способа достижения поставленной цели. Содержание самостоятельной внеаудиторной работы студентов имеет двуединый характер. С одной стороны, это совокупность учебных и практических заданий, которые должен выполнить обучающийся в процессе обучения, объект его деятельности. С другой стороны, это способ деятельности обучающегося по выполнению соответствующего учебного теоретического или практического задания.
В нормативных документах определены цели самостоятельной внеаудиторной работы студентов:
- закрепление, углубление, расширение и систематизация знаний, полученных во время аудиторных занятий, самостоятельное овладение новым учебным материалом;
- формирование общетрудовых и общепрофессиональных умений;
- формирование умений и навыков самостоятельного умственного труда;
- развитие самостоятельности мышления;
- формирование убежденности, волевых черт характера, способности к самоорганизации.
Активная самостоятельная работа студентов возможна только при наличии серьезной и устойчивой мотивации.
Основным мотивом в обучении является желание стать квалифицированным рабочим, для чего необходимо углублять знания по профессии; проявлять интерес к учебному и профессиональному поиску; стремиться к интеллектуальному росту и расширению кругозора.
Самостоятельная работа студентов проводится с целью:
- систематизации и закрепления полученных теоретических знаний и практических умений студентов;
- углубления и расширения теоретических знаний;
- формирования умений использовать справочную документацию и специальную литературу;
- развития познавательных способностей и активности студентов: творческой инициативы, самостоятельности, ответственности и организованности;
- формированию самостоятельности мышления, способностей к саморазвитию, самосовершенствованию и самореализации;
- развития исследовательских умений.
Роль самостоятельной работы возрастает, т.к. перед учебным заведением стоит задача в т. ч. и по формированию у студента потребности к самообразованию и самостоятельной познавательной деятельности.
Как надо решать задачи по физике.
Чтобы правильно и осмысленно решать задачи по физике, необходимо следовать алгоритму:
Алгоритм «Решение задач по физике»
1. Внимательно прочитайте условие задачи.
2. Установите о каком (их) физических явлениях идёт речь в задаче.
3. Вспомните основные количественные и качественные закономерности, объясняющие это (и) явление.
4. Определите, что требуется найти в задаче.
5. Установите, какие физические величины даны в задаче. Не забудьте о табличных величинах.
Примечание: Иногда использование табличных величин зашифровано текстовой информацией:
- определить массу молекулы азота,
- найти количества вещества в массе алюминия.
6. Переведите, если этого необходимо, физические величины в систему СИ (стандартные единицы измерения)
7. Определите какую (ие) количественную (ые) зависимость (и) надо использовать в решение. Для этого лучше всего определить количественные зависимости, куда входит искомая физическая величина, а также данные физических величин по условию задачи.
8. Использовать преобразования в физических формулах, получите окончательную расчётную формулу.
Примечание: при проверке правильности полученной формулы используйте размерность физической величины.
Например: Если мы должны найти силу F, то в результате сокращения размерности должны получить H (Ньютон), если получить, что-то другое, значит, формула получена не верно.
9. Выполните вычисления по полученной формуле.
10. Запишите ответ задачи.
Примечание: Иногда, для успешного решения задачи требуется выполнить чертёж. Помните о том, что правильно выполнит чертёж, помогает в решение задач, это 50% вашего успеха.
2. Основы молекулярно-кинетической теории.
Основные понятия и закономерности.
В основе молекулярно-кинетической теории строения вещества лежат три утверждения: вещество состоит из частиц; эти частицы беспорядочно движутся; частицы взаимодействуют друг с другом.
Относительно молекулярной (или атомной) массой вещества Мr называют отношение массы молекулы (или атома) m  данного вещества к
данного вещества к  массы атома углерода m
массы атома углерода m  : Mr =
: Mr = 
В Международной системе единиц количество вещества выражают в молях. Один моль- это количество вещества, в котором содержится столько же молекул или атомов, сколько атомов содержится в углероде массой 0,012 кг.
Значит, в 1 моле любого вещества содержится одно и то же число атомов или молекул. Это число атомов обозначают N  и называют постоянной Авогадро в честь итальянского учёного.
и называют постоянной Авогадро в честь итальянского учёного.
Между молярной массой Μ и относительной молекулярной массой M r существует следующая связь:
M=Mr⋅10−3
Следующей основной физической величиной в МКТ будет – количество вещества. Количество вещества, содержащегося в теле, определяется числом молекул (или атомов) в этом теле. Поскольку число молекул в макроскопических телах очень велико, для определения количества вещества в теле сравнивают число молекул в нем с числом атомов в 0,012 кг изотопа углерода 126C. Единица количества вещества называется молем (моль). Обозначают количесвта вещества – ν.
Количество вещества ν определяется как отношение числа N частиц (молекул) вещества к постоянной Авогадро N А:
ν = N/ NА = m\M
Зная массу вещества и его молярную массу М, можно найти число молей (количество вещества)
N = νNA = mMNA.
Зная молярную массу и постоянную Авогадро, можно рассчитать массу одной молекулы: m 0= M\NA = mN.
Броуновское движение-это тепловое движение взвешенных в жидкости (или газе) частиц. Идеальный газ – это газ, взаимодействие между молекулами которого пренебрежимо мало. p 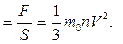
Это основное уравнение молекулярно-кинетической теории. p 
 [1]
[1]
Решение задач
Задача 1. Какое количество вещества содержится в алюминиевой отливке массой 5,4 кг? [2]

 Дано СИ Решение
Дано СИ Решение
M(Al)=27 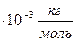

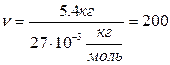 моль
моль
m (Al)=5,4 кг
 .
.
 -? Ответ: 200 моль.
-? Ответ: 200 моль.
Задача 2. Какой объем занимает 100 моль ртути?

 Дано СИ Решение
Дано СИ Решение
 (Hg)=100 моль V=
(Hg)=100 моль V=  Подставим
Подставим  в первую формулу
в первую формулу
 (Hg)=13.6·10
(Hg)=13.6·10  V=
V=  =1,5 ·10
=1,5 ·10 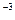 м
м 
M(Hg)=201 
 V-? Ответ: 1,5·10
V-? Ответ: 1,5·10  или 1,5 л.
или 1,5 л.
Задача 3. Чему равно число молекул в 10 г. кислорода?
Дано СИ Решение

 m (O
m (O  )=10 г. 0,01кг.
)=10 г. 0,01кг.  (1)
(1)  (2) =>
(2) => 
M(O  ) =32·10
) =32·10  Выразим N; получаем
Выразим N; получаем 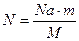
 Na=6.02·10
Na=6.02·10 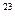 моль
моль  N=
N= 
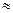 1,88·10
1,88·10 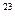 молекул
молекул
N-? Ответ: 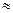 1,88*10
1,88*10 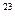 молекул
молекул
Задача 4. На изделие, поверхность которого 50 см  , нанесен слой меди толщиной 2 мкм. Сколько атомов меди содержится в покрытии?
, нанесен слой меди толщиной 2 мкм. Сколько атомов меди содержится в покрытии?
 Дано СИ Решение
Дано СИ Решение



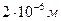 N= , но масса цинка не известна.
N= , но масса цинка не известна.
S=50 cм 
 Найдём массу цинка через объём и плотность.
Найдём массу цинка через объём и плотность.

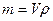 , объём найдём, зная площадь поверхности
, объём найдём, зная площадь поверхности
Na=6.02*10 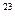 моль
моль  и толщину слоя V=Sh=>m=Sh
и толщину слоя V=Sh=>m=Sh 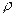
 Подставим в начальную формулу
Подставим в начальную формулу
 N-?
N-?
N= 
 молекул
молекул
Ответ:  молекул
молекул
Задача 5. Определите сколько молекул воды в объёме 2л.
Дано СИ Решение

 V=2л. 2*10
V=2л. 2*10  N=
N=  , масса воды неизвестна.
, масса воды неизвестна.
Na=6.02*10  Найдём массу воды через объём и плотность. m=
Найдём массу воды через объём и плотность. m= 


 N=
N= 


N-? Ответ: 
Задача 6. Находившаяся в стакане воде массой 0,5 кг. полностью испарилась за 30 суток. Сколько в среднем молекул воды вылетало с её поверхности за 1с?
Дано СИ Решение

 m(H
m(H  )=0.5 кг. N
)=0.5 кг. N 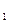 =
=  Чтобы найти число молекул, испаряющихся за
Чтобы найти число молекул, испаряющихся за
t=30 суток 2,592·10  с. 1сек. - N
с. 1сек. - N 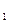 , необходимо всё число молекул разделить
, необходимо всё число молекул разделить
t 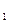 =1с на время, за которое они испарились.
=1с на время, за которое они испарились.
 =18·10
=18·10  . N=
. N=  (2).
(2).
 Подставим(2)
Подставим(2)  (1) и учтем время в секундах.
(1) и учтем время в секундах.
N 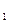 -?
-?
 N
N 
Ответ: 
Задача 7. В озеро, имеющее среднюю глубину 10м и площадь поверхности 20 км 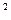 , бросили кристаллик поваренной соли массой 0,01г. Сколько молекул этой соли оказалось бы в наперстке воды объемом 2 см
, бросили кристаллик поваренной соли массой 0,01г. Сколько молекул этой соли оказалось бы в наперстке воды объемом 2 см  , зачерпнутой из озера, если полагать, что соль, растворившись, равномерно распределилась во всем объеме воды?
, зачерпнутой из озера, если полагать, что соль, растворившись, равномерно распределилась во всем объеме воды?
Дано СИ Решение
h=10м Чтобы найти N 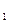 . Необходимо найти объем озера V, кол-во
. Необходимо найти объем озера V, кол-во

 S=20 км
S=20 км 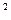 2·10
2·10  частиц соли N V=hS(1); N=
частиц соли N V=hS(1); N=  ; N
; N 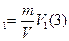
m=0.01 г 10  Подставим (1) и (2) в (3)
Подставим (1) и (2) в (3) 
V 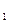 =2 см
=2 см  2·10
2·10 

Na=6.02·10 
 N
N 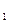 -? Ответ:6,02·10
-? Ответ:6,02·10 
 Задача 8. Каково давление кислорода, если средняя квадратичная скорость его молекул 600
Задача 8. Каково давление кислорода, если средняя квадратичная скорость его молекул 600  , а его плотность 1,54
, а его плотность 1,54  ?
?
 Дано СИ Решение
Дано СИ Решение

 Отразим на произведение m
Отразим на произведение m 


 Следовательно,
Следовательно, 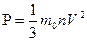
Р -?  Ответ:1,848*10
Ответ:1,848*10 
Задача 9. Какова средняя квадратичная скорость движения молекул газа, если имея массу 8 кг, он занимает объем 10 м  при давлении 250 кПа?
при давлении 250 кПа?
Дано СИ Решение

 m=8кг
m=8кг  Рассмотрим n -концентрация n=
Рассмотрим n -концентрация n= 
V=10 м 
 Следовательно,
Следовательно, 
 2,5*10
2,5*10  Выразим V из этого уравнения поэтапно:
Выразим V из этого уравнения поэтапно:
V-?  1. Умножим первую и правую части на 3V: 3РV=mV
1. Умножим первую и правую части на 3V: 3РV=mV 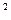
2. Разделим первую и вторую часть на m: V 
3. Возьмем квадратичный корень из первой и второй части.
V= 
V= 
Ответ: 306 м/с
Задача 10. Найти концентрацию молекул кислорода, если давление его 0,3 МПа, а средняя квадратичная скорость молекул равна 900 

 Дано CИ Решение
Дано CИ Решение
V=900  (1)
(1)  . Выразим n из уравнения (1). n=
. Выразим n из уравнения (1). n= 
 3*10
3*10  Мы не знаем массу m
Мы не знаем массу m  -массу молекулы кислорода.
-массу молекулы кислорода.
 Для этого воспользуемся малярной массой кислорода
Для этого воспользуемся малярной массой кислорода
 Na=6,02*10
Na=6,02*10 

n-? n= 
Ответ: 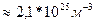
Задача 11. Найти среднюю кинетическую энергию молекулы одноатомного газа при давлении 30 кПа. Концентрация молекул газа при указанном давление 5*10 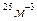 .
.

 Дано СИ Решение
Дано СИ Решение
P=30 кПа 3*10  Па Р=
Па Р=  Eк
Eк  E
E 
 N=5*10
N=5*10 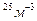
Е 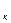 -? Ответ:9*10
-? Ответ:9*10 
 2020-06-08
2020-06-08 140
140







