Тема 12. Кислород, сера
Кислород
Кислород – элемент VI главной подгруппы. Газообразный кислород O2 без цвета и запаха, составляет 21 % об. воздуха. Озон O3 – аллотропная формы кислорода, газ голубого цвета со специфическим запахом.
Кислород – самый распространённый на Земле элемент: его содержание в земной коре (в составе оксидов, солей) составляет 47,2 % мас. Морские и пресные воды содержат 85,8 % % мас. связанного кислорода.
Следует помнить, что кислород – второй после фтора элемент по значению электроотрицательности. Максимальная степень окисления кислорода +2 (не равна номеру группы) и проявляется только в соединении OF2 (фторид кислорода), с остальными элементами проявляет отрицательную степень окисления: в подавляющем большинстве соединений –2, в пероксидах –1.
Получение O2
Получение O2 в промышленности. В больших количествах кислород получают из воздуха, например фракционной перегонкой (см. получение азота, раздел 13 данного пособия). Также кислород получают электролизом воды (см. получение водорода, раздел 1 данного пособия).
Следует запомнить реакции, которые традиционно применяются для получения O2 лаборатории:
разложение при нагревании перманганата калия:
2KMnO4  K2MnO4 + MnO2 + O2
K2MnO4 + MnO2 + O2
бертолетовой соли (в присутствии катализатора – MnO2):
2KClO3  2KCl + 3O2
2KCl + 3O2
пероксида водорода (при нагревании или в присутствии катализатора):
2H2O2 = 2H2O + O2
Химические свойства O2
Все элементы, кроме галогенов, золота, платины и благородных газов, непосредственно взаимодействуют с O2. В большинстве случаев образуются оксиды, кислород переходит в степень окисления –2.
Многие сложные вещества также реагируют кислородом – см. предыдущие разделы.
Часто реакция с O2 протекает быстро, с выделением большого количества энергии в виде света и тепла (например, с органическими веществами) – такие процессы называют горением. Дыхание, коррозия, гниение – также взаимодействии с кислородом, но медленное.
Аналитическое определение газа O2
Газ кислород поддерживает горение, тлеющая лучинка в его атмосфере вспыхивает.
Применение газа O2
1. Создание высоких температур. При увеличении концентрации кислорода скорость горения увеличивается. Во многих металлургических агрегатах и промышленных процессах для эффективного сжигания топлива вместо воздуха в горелках используют кислород.
2. В металлургии при переработке чугуна в сталь, кислород используется для окисления примесей.
3. В медицине, для дыхания.
Соединения кислорода
Элемент кислород содержится в воде, во всех оксидах и гидроксидах, во многих кислотах и солях. В этом разделе коротко охарактеризуем свойства применение более специфических кислородсодержащих веществ – озона и пероксидов.
Озон
Озон образуется в атмосфере под действием ультрафиолетового излучения. В промышленности озон получают из газообразного кислорода воздействием электрического разряда в специальном приборе – озонаторе.
O3 – очень сильный окислитель, намного более реакционноспособный, чем двухатомный кислород. В качестве примера приведем реакции:
2NO2 + O3 = N2O5 + O2
O3 + H2S + H2O = H2SO4
4O3 + 3PbS = 3PbSO4
Качественной реакцией на озон в ЕГЭ считается реакция с иодидом калия – образуется свободный йод коричневого цвета:
О3 + 2KI + Н2O = I2¯ + O2 + 2KOH
Применение озона. Озон, как сильный окислитель, применяется в химической промышленности, а также в качестве сильного дезинфицирующего средства, например, для очистки воды и воздуха от микроорганизмов (озонирование).
Пероксиды
Пероксиды – это вещества, содержащие пероксогруппу —O—O— (например, пероксид водорода Н2О2, пероксид натрия Na2O2, пероксид бария ВаО2). В пероксидах кислород имеет степень окисления −1, т.е. промежуточную степень окисления между устойчивыми 0 и –2. Поэтому пероксиды часто вступают в окислительно-восстановительные реакции. Пероксиды неустойчивы и при нагревании распадаются на оксид и кислород, например:
2H2O2  2H2O + O2
2H2O + O2
2Na2O2 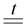 2Na2O + O2
2Na2O + O2
Пероксиды щелочных и щелочноземельных металлов реагируют с водой, образуя соответствующий гидроксид и пероксид водорода, например:
Na2O2 + 2H2O = H2O2 + 2NaOH
Пероксид натрия применяется на подводных лодках и орбитальных станциях для регенерации воздуха:
2Na2O2 + 2CO2 = 2Na2CO3 + O2
Na2O2 + CO = Na2CO3
Сера
Сера относится к широко распространённым элементом, встречается в виде сульфидов (FeS, FeS2, ZnS и др.), сульфатов (Na2SO4×10Н2O, СаSO4×2Н2O и др.), а также и в виде простого вещества – элементарной серы. Также сера в больших количествах содержится в природном газе в виде H2S и SO2.
Кристаллическая сера (ромбическая или моноклинная) – желтые кристаллы, состоящие из молекул S8. Аморфная (пластическая) сера – коричневая масса, похожая на резину.
Химические свойства серы
В отличие от кислорода, в атоме серы имеется свободный d -подуровень, поэтому сера в соединениях может образовывать не только 2 ковалентные связи, но и 4 или 6. Степени окисления серы –2, 0, +2, +4, +6.
1. Сера – типичный неметалл, при нагревании реагирует практически со всеми элементами – кроме N2, I2, Au, Pt, благородных газов.
2. Как окислитель (до степени окисления –2), сера соединяется с металлами, водородом, углеродом, кремнием, фосфором, например
2S0 + C0 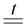 C+4S–22
C+4S–22
3S0 + 2Al0 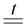 Al+32S–23
Al+32S–23
В реакциях с кислородом и галогенами (кроме йода) сера окисляется
S + О2 = SО2
S + Cl2 = SCl2
S + 3F2 = SF6
3. Сера реагируют со многими сложными веществами:
– с кислотами-окислителями
S + 2H2SO4 (конц.) = 3SO2 + 2H2O
S + 6HNO3 (конц.) = H2SO4 + 6NO2 + 2H2O
– диспропорционирует в растворе щелочи
3S + 6KOH = K2SO3 + 2K2S + 3H2O
Применение серы
Сера – яд для микроорганизмов: используется в медицине, для обработки растений и т.п. Большое количество серы требуется для вулканизации каучуков в резину. Сера используется для производства пороха и спичек. В последнее время сера является основным сырьём производства серной кислоты.
 2020-06-08
2020-06-08 117
117







