Промышленный способ – взаимодействие простых веществ
H2 + S 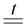 H2S
H2S
В лаборатории сероводород получают воздействием кислот на сульфиды
FeS + 2HCl = FeCl2 + H2S
Химические свойства H2S
1. Сероводород содержит серу в низшей степени окисления –2, поэтому H2S может быть только восстановителем. Даже без нагревания и на воздухе и в воде сероводород легко окисляется кислородом
2H2S + O2 = 2S + 2H2O
Горение сероводорода протекает по уравнению
2H2S + 3O2 = 2SO2 + 2H2O
В ЕГЭ много заданий, где в ОВР в качестве восстановителя используется сероводород, например
2H2S + SO2 = 3S + 2H2O
3H2S + 2KMnO4 = 2MnO2¯ + 3S¯ + 2H2O + 2KОН
H2S + 3H2SO4 (конц.) = 4SO2 + 4H2O
2. Сероводород достаточно хорошо растворим в воде, в растворе образует слабую двухосновную сероводородную кислоту:
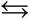 H2S Н+ + HS–
H2S Н+ + HS–
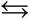 HS– Н+ + S2–
HS– Н+ + S2–
Сероводородная кислота – типичная слабая кислота; образует кислые соли – гидросульфиды и средние – сульфиды. Гидросульфиды почти все растворимы, сульфиды щелочных, щелочноземельных металлов и аммония – тоже, сульфиды остальных металлов нерастворимы, кроме того, многие имеют характерную окраску: ZnS белый, MnS розовый, CdS желтый, PbS, CuS, FeS черные. Поэтому H2S и сульфиды используют для аналитического определения металлов, а растворы солей некоторых металлов – для обнаружения сероводорода.
SO2 и сульфиты
SO2 – оксид серы(IV) (диоксид серы, сернистый газ, сернистый ангидрид) – бесцветный газ с характерным серным запахом. Токсичен.
Получение SO2
Получение в промышленности – обжиг серы и некоторых сульфидов, например
S + O2 = SO2
4FeS2 + 11O2 = 2Fe2O3 + 8SO2
2PbS + 3O2 = 2PbO + 2SO2
В лаборатории – действием сильной кислоты на сульфиты, например
Na2SO3 + 2H2SO4 = 2NaHSO4 + H2O + SO2
Химические свойства SO2
Растворяется в воде с образованием нестойкой сернистой кислоты H2SO3. Сернистая кислота слабая, образует соли сульфиты и гидросульфиты
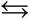 H2SO3 H+ + HSO3–
H2SO3 H+ + HSO3–
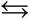 HSO3– H+ + SO32–
HSO3– H+ + SO32–
Сернистая кислота (точнее раствор диоксид серы в воде) проявляет все свойства кислот – реагирует с основными оксидами, основаниями, растворами солей, например
SO2 + 2NaOH = Na2SO3 + H2O
SO2 + NH3×H2O = NH4HSO3
SO2 + Na2CO3 = Na2SO3 + CO2
SO2 + H2O + Na2SO3 = 2NaHSO3
Диоксид серы и сульфиты содержат серу в степени окисления +4, в ОВР они могут быть как окислителями, так и восстановителями.
Восстановительные свойства более выражены:
SO2 + 2HNO3 = H2SO4 + 2NO2
3K2SO3 + K2Cr2O7 + 4H2SO4 = 4K2SO4 + Cr2(SO4)3 + 4H2O
С сильными восстановителями может проявлять себя как окислитель:
SO2 + 2CO = 2CO2 + S
2H2S + SO2 = 3S + 2H2O
Аналитическое определение SO2 и сульфитов
При добавлении сильной кислоты к сульфитам выделяется газ характерным запахом.
SO2 и сульфиты – сильные восстановители, их аналитическое обнаружение основано на изменении окраски окислителя (например, KMnO4, K2Cr2O7).
Применение SO2 и сульфитов
1. Сернистый газ убивает микроорганизмы, им окуривают овощехранилища и склады, используют в качестве консерванта.
2. При пропускании SO2 через раствор NaOH образуются т.н. сульфитные щелоки (барды) – их широко используют при производстве бумаги, для отбеливания тканей и др.
3. Бóльшая SO2 часть расходуется на производство серной кислоты.
Промышленный синтез серной кислоты включен в кодификатор (раздел «Общие представления о промышленных способах получения важнейших веществ»).
В промышленности серную кислоту получают окислением диоксида серы кислородом в серный ангидрид
2SO2 + O2 = 2SO3
Окисление происходит в так называемом контактном аппарате, катализатором служит оксид ванадия(V), температура – около 500°С. Полученный SO3 поглощается концентрированной серной кислотой – образуется технический продукт олеум. При разбавлении олеума водой получают концентрированную серную кислоту, содержащую 92–96 % H2SO4. Этот способ производства называется контактным, сегодня он практически вытеснил нитрозный способ. При нитрозном способе главная стадия – окисление SO2 в SO3 осуществляется по реакции
NO2 + SO2 = NO + SO3
SO3, серная кислота и сульфаты
SO3 – оксид серы(VI), триоксид серы, серный ангидрид – белое аморфное вещество, хорошо растворяется в воде и концентрированной серной кислоте. Типичный кислотный оксид.
Серная кислота H2SO4 – бесцветная, вязкая жидкость. В разбавленном растворе – типичная сильная кислота, образует соли сульфаты и гидросульфаты.
Концентрированная серная кислота очень гигроскопична, ее часто используют в качестве осушителя, водоотнимающего агента в органических реакциях. При растворении серной кислоты в воде выделяется большое количество теплоты, поэтому при приготовлении раствора серной кислоты необходимо кислоту приливать в воду – тяжелая кислота опустится на дно, разбрызгивания жидкости не произойдет.
Концентрированная серная кислота обугливает органику, например сахарозу
C12H22O11 + H2SO4 (конц.) = 12С + H2SO4 (разб.)
Серная кислота сильная и нелетучая, она может вытеснять летучие соляную и азотную кислоту из их сухих солей
NaNO3 (тв.) + H2SO4 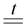 HNO3 + NaHSO4
HNO3 + NaHSO4
NaCl (тв.) + H2SO4 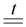 HCl + NaHSO4
HCl + NaHSO4
Концентрированная серная кислота – окислитель средней силы, за счет восстановления серы в степени окисления +6.
Серный ангидрид также способен проявлять окислительные свойства в реакциях с сильными восстановителями, например
5SO3 + 2Р = 5SO2 + P2O5
Соли серной кислоты – купоросы, гипс, сульфаты щелочных металлов – рассмотрены в предыдущих разделах.
Аналитическое определение серной кислоты и сульфатов. При добавлении к раствору, содержащему сульфат ион SO42– растворимой соли бария (например, Ba(NO3)2, BaCl2) выпадает белый осадок сульфата бария BaSO4, нерастворимый в кислотах (BaSO3, BaСO3 в кислотах растворяются).
Применение серной кислоты. Это сильная, недорогая, нелетучая кислота применяется во многих отраслях промышленности. Мировое производство серной кислоты около 200 млн. тонн в год.
 2020-06-08
2020-06-08 278
278








