- Определение калориметрической температуры:
tк = (Qнр + Qфт + Qфв)/(скVд), (1.38)
где Qнр – низшая теплота сгорания топлива, кДж/кг или кДж/м3;
Qфт = стtт - физическое тепло подогретого топлива, кДж/м3;
Qфв = свtвLα – физическое тепло подогретого воздуха, кДж/м3;
ст и св – удельная теплоемкость топлива при tт и удельная теплоемкость воздуха при tв, кДж/(м3К) (прилож.1).
При расчете калориметрической температуры необходимо определить теплоемкость продуктов сгорания сдк, которая является справочной величиной и зависит от температуры, но т.к. tк, неизвестна, то находятсначала величину калориметрической энтальпии дыма
iк = (Qнр + Qфт + Qфв) / Vд , (1.39)
и далее расчет ведут методом последовательных приближений, т.е. задают какую-либо температуру t1, определяют теплоемкость дыма при этой температуре с1 (прилож.2, 3), перемножением этих величин находят энтальпию при выбранной температуре i1 = с1t1, полученное значение i1 сравнивают с iк. Если они не равны, то задают другую температуру t2, и расчет повторяют. Далее калориметрическую температуру можно найти интерполяцией полученных значений
tк = t1 + (t2 - t1)(iк – i1) / (i2 – i1). (1.40)
Задать температуру с достаточной степенью точности можно, используя i-t диаграмму (рис. 1.1), где относительное содержание воздуха в дыме равно
VL = (Lα - Lo) ·100/ Vд, %. (1.41)
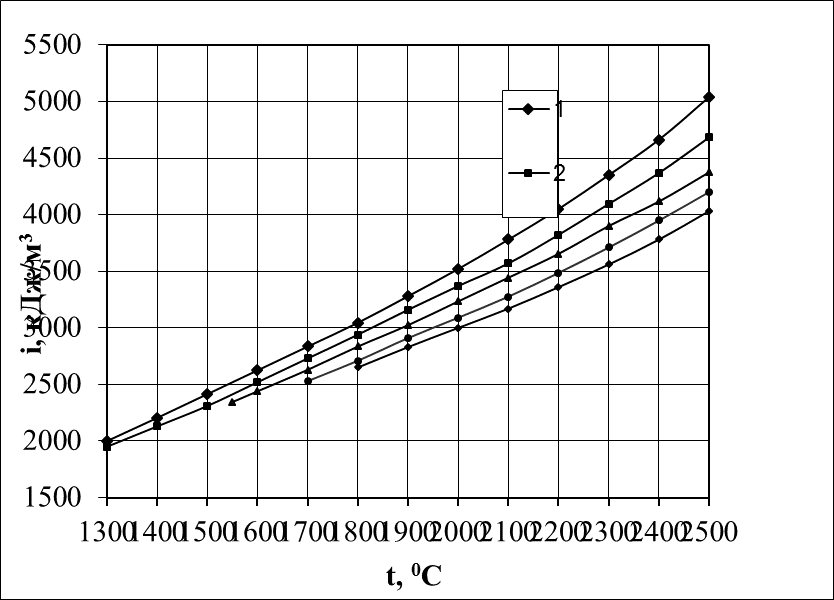
Рисунок 1.1 i - t диаграмма.
1 – VL = 0% (в продуктах горения нет избыточного воздуха);
2 – VL = 20%; 3 – VL = 40%; 4 – VL = 60%.
В расчетах теплоемкость дыма при данной температуре сt определяют суммированием произведений теплоемкости каждого компонента дыма сit при этой же температуре (приложение 2) на его объемную долю в дыме:
сt = ∑(сit · j %)/100, (1.42)
Аналогично можно определять энтальпию смеси газов (приложение 3):
it = ∑(iit · j %)/100, (1.42а)
- Определение действительной температуры.
Действительная температура значительно ниже калориметрической, это обусловлено наличием потерь тепла, организацией процесса сжигания топлива, условиями теплообмена, конструкцией печи и т.д. Действительную температуру определяют по значению калориметрической температуры:
tдейств = η·tк, (1.43)
где η - пирометрический коэффициент, для большинства металлургических печей η = 0,6 ÷ 0,8.
Для сравнения энергетической ценности различных видов топлива, введено понятие условного топлива, теплота сгорания этого топлива принята равной Qу.т.= 29330 кДж/кг. Пересчет расхода данного топлива в единицы условного топлива Bу.т. проводят по формуле
Ву.т. = В ·(Qнр / Qу.т.), (1.55)
здесь Ву.т., В – расход условного и данного топлива, кг или кг/с,
величина
Qнр / Qу.т. = Эк (1.56)
называется калорийным эквивалентом, кг у.т./кг данного топлива.
Пример расчета горения газообразного топлива.
Пример 1.4.
Сделать полный расчет горения влажного газообразного топлива, если состав сухого газа, %:
CH4 = 93,9; C2H6 = 0,3; C3H8 = 0,13; C4H10 = 0,07; N2 = 0,4; CO2 = 5,2; gH2O = 22 г/м3 (у вас gH2O = 0, т.к. расчет будем вести на сухое топливо, т.е. вам не надо делать перерасчет на влажный газ).
Коэффициент расхода воздуха α = 1,1; воздух подогрет до температуры tв = 300 оС (у вас tв –по заданию) и в своем составе содержит 25 % (ко2 = 0,25) кислорода.
Решение (здесь расчет показан по составу влажного газа, у вас просто состав по заданию и gH2O = 0)
Сначала по формулам (1.12) – (1.14) необходимо определить состав влажного газа. Согласно (1.12) СН4вл = k · СН4сух, здесь коэффициент пересчета
k = 100 / (100 + 0,124 · gH2O) = 100 / (100 + 0,124 · 22) = 0,973, тогда
CH4вл = 0,973 · 93,9 = 91,406%,
C2H6 вл =0,973 · 0,3 = 0,292 %,
C3H8 вл = 0,973 · 0,13 = 0,1265 %,
C4H10 =0,973 · 0,07 = 0,0681 %,
N2 вл =0,973 · 0,4 = 0,389 %,
CO2 вл = 0,973 · 5,2 = 5,062 %,
содержание водяных паров во влажном газе составит (1.14)
Н2О = 0,973 · 0,124·22 =2,656%.
Таким образом, во влажном газе семь компонентов, т.е. на один (влагу) больше, чем в сухом.
Проверяем сумму компонентов топлива, - Σ = 100 %, пересчет сделан верно.
Дальнейший расчет ведется по составу влажного топлива (у вас по вашему сухому составу, где Н2О конечно нет).
Перед дальнейшим расчетом рекомендуется выделить (подчеркнуть) все горючие соединения в топливе - это CH4, C2H6 , C3H8, C4H10 .
CH4 = 91,406; C2H6 = 0,292; C3H8 = 0,1265; C4H10 = 0,0681; N2 = 0,389; CO2 = 5,062; Н2О = 2,656 %.
- Теплоту сгорания топлива рассчитаем по формуле (1.26), в ней число слагаемых должно быть равно количеству горючих (подчеркнутых вами) компонентов:
Qн = 358CH4 + 637C2H6 + 913C3H8 + 1186C4H10 =
358·91,406 + 637·0,292 + 913·0,1265 + 1186·0,0681 = 33091 кДж/м3.
- Теоретический расход кислорода (1.27). В формуле число слагаемых также равно количеству горючих компонентов за вычетом кислорода, если бы он имелся в топливе:
Vo2 = 0,01[2CH4 + S(m+0,25n)·CmHn ] =
= 0,01[2CH4 + 3,5 C2H6 + 5 C3H8 + 6,5 C4H10] =
= 0,01[2·91,406 + 3,5·0,292 + 5·0,1265 + 6,5·0,0681] = 1,848, м3/ м3.
- Теоретический расход воздуха Lo, необходимый для полного сгорания 1м3 топлива (1.28):
Lo = Vo2 / ко2 = 1,848/0,25 = 7,392 м3/м3.
- Действительный расход воздуха Lα (1.29):
Lα = α ·Lo = 1,1·7,392 = 8,1312 м3/м3.
- Для определения общего объема дыма рассчитаем объемы отдельных компонентов дыма (1.31) – (1.35), м3/м3:
В уравнении для определения объема СО2 количество слагаемых равно количеству компонентов, содержащих углерод (выпишите их все в формулу, а потом перед ними расставьте значения равные m в CmHn):
VСО2 = 0,01(CH4 + 2C2H6 + 3C3H8 + 4C4H10 + CO2) =
= 0,01(91,406+ 2·0,292 + 3·0,1265 + 4·0,0681 + 5,062) = 0,977 м3/м3;
В уравнении для определения объема Н2О количество слагаемых равно количеству компонентов, содержащих водород (выпишите их все в формулу, а потом перед ними расставьте значения равные n/2 из CmHn):
VН2О = 0,01(2CH4 + ∑(0,5n·CmHn) + Н2О) =
= 0,01(2·СН4 + 3·C2H6 + 4·C3H8 + 5·C4H10 + Н2О) =
= 0,01(2·91,406 + 3·0,292 + 4·0,1265 + 5·0,0681 + 2,656) = 1,871;
VSO2 = 0,01H2S = 0, т.к. сероводород в топливе отсутствует;
VN2 = 0,01·N2 + (1 - kо2) · Lα = 0,01·0,389+ (1 – 0,25) · 8,1312 = 6,102;
VО2изб = кО2 · (α – 1) · Lо = 0,25 ·(1,1 - 1) · 7,392 = 0,185 м3/м3.
Тогда общий объем газообразных продуктов сгорания (дыма) равен (1.30)
Vд = VСО2 + VН2О + VSO2 + VN2 + VО2изб =
0,977 + 1,871 + 6,102 + 0,185 = 9,1353 м3/м3.
-Состав продуктов сгорания, %, (1.36 ):
% СО2 = (VСО2/ Vд)·100 = (0,977/9,1353) ·100 = 10,695;
аналогично % H2O = 20,481; % N2 = 66,799; %O2изб = 2,025.
Сумма равна 100%.
- Материальный баланс горения газообразного топлива составляем аналогично материальному балансу горения жидкого топлива (см. теорию выше и пример 1.3).
Поскольку воздух, используемый для горения обогащенный (ко2 = 0,25), то его плотность равна (1.37):
ρовозд = (32·%О2 + 28·%N2)/(22,4·100) = (32· 25 + 28·75)/(22,4·100) =
= 1,2946 кг/м3.
Плотность газообразного топлива определяем также по (1.37), при этом нужно проследить, чтобы количество слагаемых было равно количеству компонентов топлива:
ρогаза = (16·%CH4 + 30·%C2H6 + 44·%C3H8 + 58·%C4H10 + 44·%CO2 +
+ 28·%N2 + 18·% Н2О)/(22,4·100) = (16·91,406 + 30·0,292 + 44·0,1265 +
+ 58·0,0681 + 44·5,062 + 28·0,389 + 18·2,656)/(22,4·100) = 0,786 кг/м3,
плотность дыма
ρод = (44·%СО2 + 18·%H2O + 28·%N2 +32· %O2изб) /(22,4·100) =
= (44·10,695 + 18·20,481 + 28·66,799 +32·2,025)/(22,4·100) = 1,239 кг/м3,
тогда масса топлива Мт = 1·0,786 = 0,786 кг, масса воздуха Мвозд = 1,2946·8,1312 = 10,53 кг, масса дыма Мд = 1,239·9,1353 = 11,319 кг. Полученные результаты сводим в таблицу.
Материальный баланс горения 1м3 газообразного топлива.
| Статьи прихода | Масса, кг | Статьи расхода | Масса, кг |
| Масса топлива Мт | 0,786 | Масса дыма Мд | 11,319 |
| Масса воздуха Мвозд | 10,530 | ||
| Масса прихода Мп | 11,316 | Масса расхода МР | 11,319 |
Невязка баланса составила 100·(11,319 - 11,316)/ 11,319 = 0,03 %, это значительно меньше разрешенных 0,5 %, уточнение не требуется.
- Температура горения топлива определяется так же, как в примере 1.3.
Калориметрическая энтальпия дыма (1.39)
iк = (Qнр + Qфв)/Vд = (33091 +3215)/ 9,1353 = 3974 кДж/м3.
По i-t диаграмме (рис.1.1.) задаем t1 = 2200 оС, при этой температуре
i1 = (5464·10,695 + 4359·20,481 + 3296·66,799 + 3487·2,025)/100 = 3749 кДж/м3,
поскольку i1<iк (3749<3974), зададим t2 = 2400 оС, т.е. > t1, при этой температуре
i2 = 4108 кДж/м3, это > iк,тогда (1.40)
tк = t1 + (t2 - t1)(iк – i1)/(i2 – i1) =
= 2200 +(2400 – 2200)(3974 – 3749)/(4108 – 3749) = 2325 оС,
а действительная температура составит
tдейств = η·tк = 0,7 ·2325 = 1628 оС.
_____________________________________________________
Вставка из примера 1.3. здесь цифры из предыдущего расчета этого примера, но ход расчета будет аналогичным.
- Определение действительной температурыначинают с определения калориметрической температуры, для этого сначала находят величину калориметрической энтальпии дыма (1.39). Поскольку топливо не подогрето, то Qфт = 0.
Теплота, внесенная подогретым воздухом,
Qфв = свtвLα = 1,312·250 ·12,863 = 4227,811 кДж/м3,
здесь теплоемкость воздуха св = 1,312 кДж/(м3К) выбрана по прилож.1 (или 2) при tв, = 250 оС. Тогда
iк = (Qнр + Qфт + Qфв)/Vд = (41129 + 0 + 4227,811)/13,598 = 3336 кДж/м3.
Используя i-t диаграмму (рис.1.1.) задаемся температурой t1. При содержании воздуха в дыме равном:
VL = (Lα – Lo) ·100 / Vд, %.
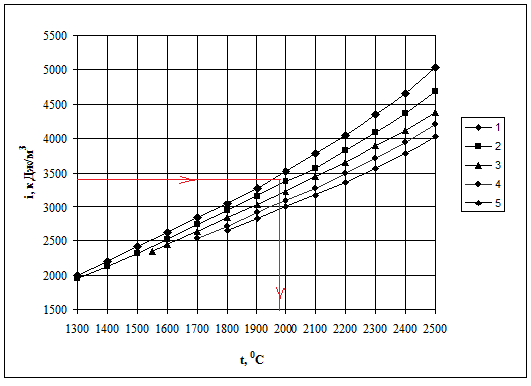
Рисунок 1.1 i - t диаграмма.
1 – VL = 0% (в продуктах горения нет избыточного воздуха);
2 – VL = 20%; 3 – VL = 40%; 4 – VL = 60%.
VL = (Lα - Lo) ·100/VД = (12,863 – 10,719) ·100/13,598 = 15,8 % (это значение находится ближе ко второй кривой) найденному значению iк соответствует температура 1990оС, но для удобства выбора энтальпии или уд.теплоемкости по справочнику лучше задать круглую цифру t1 = 2000 оС. При этой температуре энтальпия дыма (1.42а)
i1д = (i1CO2 · %СО2 + i1H2O · %Н2О + i1SO2 · %SO2 + i1N2 · %N2 + i1О2· %
O2изб) /100 = (4910·11,442 + 3890·10,479 + 2970·74,77 + 3143·3,309)/100 =
3294 кДж/м3,
здесь значения энтальпий компонентов выбраны по прил.3 при 2000 оС, (i1SO2 = i1CO2, поэтому %SO2 сложен с %СО2). Найденное значение энтальпии не равно величине калориметрической энтальпии i1д<iк (3294 < 3336), поэтому задаем другую температуру, t2 = 2100 оС, т.е. > t1. Расчет энтальпии дыма повторяем снова:
i2д = (5187·11,442 + 4122·10,479 + 3132·74,77 + 3315·3,309)/100 = 3477 кДж/м3, это больше iк, значит искомая калориметрическая температура находится в интервале выбранных температур.
Тогда по (1.40)
tк = t1 + (t2 - t1)(iк – i1) / (i2 – i1) =
= 2000 + (2100 – 2000)(3336 -3294)/(3477 - 3294) = 2023 оС.
При этом значении калориметрической температуры действительная температура равна (1.43)
tдейств = η·tк = 0,7·2023 = 1416 оС,
здесь значение пирометрического коэффициента приняли η = 0,7.
Полученные результаты расчета горения топлива могут быть использованы при решении задач по механике газов, по теплообмену, тепловому балансу печей и т.д.
____________________________________________________________
Приложение 2
Средние теплоемкости, воздуха и газов при различных температурах, кДж/(м3К), и давлении 101,3 кПа
| Температура | СО2 | N2 | О2 | Н2О | Воздух сухой (атмосферный) | |
| К | 0 С | |||||
| 273 | 0 | 1,6204 | 1,2927 | 1,3076 | 1,4914 | 1,3009 |
| 373 | 100 | 1,7200 | 1,3013 | 1,3193 | 1,5019 | 1,3051 |
| 473 | 200 | 1,8079 | 1,3030 | 1,3369 | 1,5174 | 1,3097 |
| 573 | 300 | 1,8808 | 1,3080 | 1,3583 | 1,5379 | 1,3181 |
| 673 | 400 | 1,9436 | 1,3172 | 1,3796 | 1,5592 | 1,3302 |
| 773 | 500 | 2,0453 | 1,3294 | 1,4005 | 1,5831 | 1,3440 |
| 873 | 600 | 2,0592 | 1,3419 | 1,4152 | 1,6078 | 1,3583 |
| 973 | 700 | 2,1077 | 1,3553 | 1,4370 | 1,6338 | 1,3725 |
| 1073 | 800 | 2,1517 | 1,3683 | 1,4529 | 1,6601 | 1,3821 |
| 1173 | 900 | 2,1915 | 1,3817 | 1,4663 | 1,6865 | 1,3993 |
| 1273 | 1000 | 2,2266 | 1,3938 | 1,4801 | 1,7133 | 1,4118 |
| 1373 | 1100 | 2,2593 | 1,4056 | 1,4935 | 1,7397 | 1,4236 |
| 1473 | 1200 | 2,2886 | 1,4065 | 1,5065 | 1,7657 | 1,4347 |
| 1573 | 1300 | 2,3158 | 1,4290 | 1,5123 | 1,7908 | 1,4453 |
| 1673 | 1400 | 2,3405 | 1,4374 | 1,5220 | 1,8151 | 1,4550 |
| 1773 | 1500 | 2,3636 | 1,4470 | 1,5312 | 1,8389 | 1,4642 |
| 1873 | 1600 | 2,3849 | 1,4554 | 1,5400 | 1,8619 | 1,4730 |
| 1973 | 1700 | 2,4042 | 1,4625 | 1,5483 | 1,8841 | 1,4809 |
| 2073 | 1800 | 2,4226 | 1,4705 | 1,5559 | 1,9055 | 1,4889 |
| 2173 | 1900 | 2,4393 | 1,4780 | 1,5638 | 1,9252 | 1,4960 |
| 2273 | 2000 | 2,4552 | 1,4851 | 1,5714 | 1,9449 | 1,5031 |
| 2373 | 2100 | 2,4699 | 1,4914 | 1,5743 | 1,9633 | 1,5094 |
| 2473 | 2200 | 2,4837 | 1,4981 | 1,5851 | 1,9813 | 1,5174 |
| 2573 | 2300 | 2,4971 | 1,5031 | 1,5923 | 1,9984 | 1,5220 |
| 2673 | 2400 | 2,5097 | 1,5085 | 1,5990 | 2,0148 | 1,5274 |
| 2773 | 2500 | 2,5214 | 1,5144 | 1,6057 | 2,0307 | 1,5341 |
Приложение 3.
Энтальпия атмосферного воздуха и газов, кДж/м3, при различных температурах и давлении 101,3 кПа
| Температура | СО2 | N2 | О2 | Н2О | Воздух сухой (атмосферный) | |
| К | 0 С | |||||
| 373 | 100 | 172,00 | 130,13 | 131,93 | 150,18 | 130,51 |
| 473 | 200 | 361,67 | 260,60 | 267,38 | 303,47 | 261,94 |
| 573 | 300 | 564,24 | 392,41 | 407,48 | 461,36 | 395,42 |
| 673 | 400 | 777,44 | 526,89 | 551,85 | 623,69 | 532,08 |
| 773 | 500 | 1001,78 | 664,58 | 700,17 | 791,55 | 672,01 |
| 873 | 600 | 1236,76 | 805,06 | 851,64 | 964,68 | 814,96 |
| 973 | 700 | 1475,41 | 940,36 | 1005,24 | 1143,64 | 960,75 |
| 1073 | 800 | 1718,95 | 1094,65 | 1162,32 | 1328,11 | 1109,05 |
| 1173 | 900 | 1972,43 | 1243,55 | 1319,67 | 1517,87 | 1259,36 |
| 1273 | 1000 | 2226,75 | 1393,86 | 1480,11 | 1713,32 | 1411,86 |
| 1373 | 1100 | 2485,34 | 1546,14 | 1641,02 | 1913,67 | 1565,94 |
| 1473 | 1200 | 2746,44 | 1699,76 | 1802,76 | 2118,78 | 1721,36 |
| 1573 | 1300 | 3010,58 | 1857,74 | 1966,05 | 2328,01 | 1879,27 |
| 1673 | 1400 | 3276,75 | 2012,36 | 2129,93 | 2540,25 | 2036,87 |
| 1773 | 1500 | 3545,34 | 2170,55 | 2296,78 | 2758,39 | 2196,19 |
| 1873 | 1600 | 3815,86 | 2328,65 | 2463,97 | 2979,13 | 2356,68 |
| 1973 | 1700 | 4087,10 | 2486,28 | 2632,09 | 3203,05 | 2517,60 |
| 2073 | 1800 | 4360,67 | 2646,74 | 2800,48 | 3429,90 | 2680,01 |
| 2173 | 1900 | 4634,76 | 2808,22 | 2971,30 | 3657,85 | 2841,43 |
| 2273 | 2000 | 4910,51 | 2970,25 | 3142,76 | 3889,72 | 3006,26 |
| 2373 | 2100 | 5186,81 | 3131,96 | 3314,85 | 4121,79 | 3169,77 |
| 2473 | 2200 | 5464,20 | 3295,84 | 3487,44 | 4358,83 | 3338,21 |
| 2573 | 2300 | 5746,39 | 3457,20 | 3662,33 | 4485,34 | 3500,54 |
| 2673 | 2400 | 6023,25 | 3620,58 | 3837,64 | 4724,37 | 3665,80 |
| 2773 | 2500 | 6303,53 | 3786,09 | 4014,29 | 5076,74 | 3835,29 |
| 2873 | 2600 | 6552,00 | 3952,00 | 4180,00 | 5376,00 | 4017,00 |
| 2973 | 2700 | 6837,00 | 4126,00 | 4363,00 | 5631,00 | 4195,00 |
 2020-06-08
2020-06-08 933
933







