Щелочные металлы
Щелочными металлами называются химические элементы-металлы IA группы Периодической системы Д. И. Менделеева: литий Li, натрий Na, калий K, рубидий Rb, цезий Cs и франций Fr.
Электронное строение атомов. На внешнем энергетическом уровне атомы щелочных металлов имеют один электрон ns1. Поэтому для всех металлов группы IA характерна степень окисления +1.
Этим объясняется сходство свойств всех щелочных металлов.
Для них (сверху вниз по группе) характерно:увеличение радиуса атомов;уменьшение электроотрицательности;усиление восстановительных, металлических свойств.
Нахождение в природе. Из щелочных металлов наиболее широко распространены в природе натрий и калий. Но из-за высокой химической активности они встречаются только в виде соединений.
Основными источниками натрия и калия являются:
· каменная соль (хлорид натрия NaCl),
· глауберова соль, или мирабилит — декагидрат сульфата натрия Na2SO4⋅10H2O,
· сильвин — хлорид калия KCl,
· сильвинит — двойной хлорид калия-натрия KCL ⋅NaCl и др.
· Соединения лития, рубидия и цезия в природе встречаются значительно реже, поэтому их относят к числу редких и рассеянных.
Физические свойства простых веществ. В твёрдом агрегатном состоянии атомы связаны металлической связью. Наличие металлической связи обусловливает общие физические свойства простых веществ-металлов: металлический блеск, ковкость, пластичность, высокую тепло- и электропроводность.
В свободном виде простые вещества, образованные элементами IA группы — это легкоплавкие металлы серебристо-белого (литий, натрий, калий, рубидий) или золотисто-жёлтого (цезий) цвета, обладающие высокой мягкостью и пластичностью.

Наиболее твёрдым является литий, остальные щелочные металлы легко режутся ножом и могут быть раскатаны в фольгу.
Только у натрия плотность немного больше единицы ρ=1,01 г/ см 3, у всех остальных металлов плотность меньше единицы.
Химические свойства. Щелочные металлы обладают высокой химической активностью, реагируя с кислородом и другими неметаллами.
Поэтому хранят щелочные металлы под слоем керосина или в запаянных ампулах. Они являются сильными восстановителями.
Все щелочные металлы активно реагируют с водой, выделяя из неё водород.
Пример:
2Na+2H 2O=2NaOH+H2↑.
Взаимодействие натрия с водой протекает с выделением большого количества теплоты (т. е. реакция является экзотермической). Кусочек натрия, попав в воду, начинает быстро двигаться по её поверхности. Под действием выделяющейся теплоты он расплавляется, превращаясь в каплю, которая, взаимодействуя с водой, быстро уменьшается в размерах. Если задержать её, прижав стеклянной палочкой к стенке сосуда, капля воспламенится и сгорит ярко-жёлтым пламенем.
Получение. Металлический натрий в промышленности получают главным образом электролизом расплава хлорида натрия с инертными (графитовыми) электродами.
В расплаве хлорида натрия присутствуют ионы:
NaCl⇄Na++Cl−.
При электролизе
на катоде восстанавливаются катионы Na+, а на аноде окисляются анионы Cl−:
катод (–): 2Na++2e=2Na,
анод (+): 2Cl−−2e=Cl2↑⏐.
Суммарное уравнение реакции при электролизе расплава хлорида натрия:
2NaCl→2Na+Cl2↑.
Соединения щелочных металлов. В свободном виде в природе щелочные металлы не встречаются из-за своей исключительно высокой химической активности. Некоторые их природные соединения, в частности соли натрия и калия, довольно широко распространены, они содержатся во многих минералах, растениях, природных водах.
Рассмотрим основные соединения щелочных металлов на примере соединений натрия и калия — наиболее важных представителей этой группы элементов.
Оксиды М2O — твёрдые вещества. Имеют ярко выраженные основные свойства: взаимодействуют с водой, кислотами и кислотными оксидами (запишите уравнения соответствующих реакций).
Оксиды натрия Na2O и калия К2O получают, прокаливая пероксиды с соответствующими металлами, например:
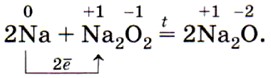
Гидроксиды МОН — твёрдые белые вещества. Очень гигроскопичны. Хорошо растворяются в воде с выделением большого количества теплоты. Их относят к щелочам, они проявляют ярко выраженные свойства сильных растворимых оснований: взаимодействуют с кислотами, кислотными оксидами, солями, амфотерными оксидами и гидроксидами (запишите уравнения соответствующих реакций в молекулярной и ионной формах). Гидроксиды щелочных металлов образуются при взаимодействии щелочных металлов или их оксидов с водой (запишите уравнения соответствующих реакций).
Гидроксид натрия NaOH в технике известен под названиями едкий натр, каустическая сода, каустик. Техническое название гидроксида калия КОН — едкое кали.
Оба гидроксида — NaOH и КОН — разъедают ткани и бумагу, поэтому их называют также едкими щелочами.
Едкий натр применяют в больших количествах для очистки нефтепродуктов, в бумажной и текстильной промышленности, для производства мыла и волокон. Едкое кали дороже и применяется реже. Основная область его применения — производство жидкого мыла.
Соли щелочных металлов — твёрдые кристаллические вещества ионного строения. Почти все соли натрия и калия растворимы в воде. Наиболее важные их соли — карбонаты, сульфаты и хлориды.
Na2CO3 — карбонат натрия, образует кристаллогидрат Na2CO3 • 10Н2O, известный под названием кристаллическая сода, которую применяют в производстве стекла, бумаги, мыла. Это средняя соль.
Вам в быту более известна кислая соль — гидрокарбонат натрия NaHCO3 (пищевая сода), которую применяют в пищевой промышленности, в медицине.
К2СO3 — карбонат калия, техническое название — поташ, используют в производстве жидкого мыла и для приготовления тугоплавкого стекла, а также в качестве удобрения.
Na2SO4 • 10H2O — кристаллогидратат сульфата натрия, техническое название — глауберова соль, применяют для производства соды и стекла и в качестве слабительного средства.
NaCl — хлорид натрия, или поваренная соль, хорошо известен вам из курса 9 класса. Хлорид натрия является важнейшим сырьём в химической промышленности, широко применяется в быту (рис. 52).
Ионы натрия и калия очень важны для живых организмов: Na+ — главный внеклеточный ион, содержится в крови и лимфе, а К+ — основной внутриклеточный ион. Они выполняют разные функции в организме, но предпочитают «работать» вместе. Соотношение концентраций этих ионов регулирует давление крови в живом организме; обеспечивает перемещение растворов солей из корней в листья растений.
Калий поддерживает работу сердечной мышцы, поэтому нехватка калия в организме отрицательно сказывается на здоровье человека. Калий необходим растениям, при его недостатке снижается интенсивность фотосинтеза.

Взрослый человек должен в сутки потреблять с пищей 3,5 г калия. С помощью соединений калия можно устранять отёки. В этом случае нужно увеличить потребление калия до 5 г в сутки.
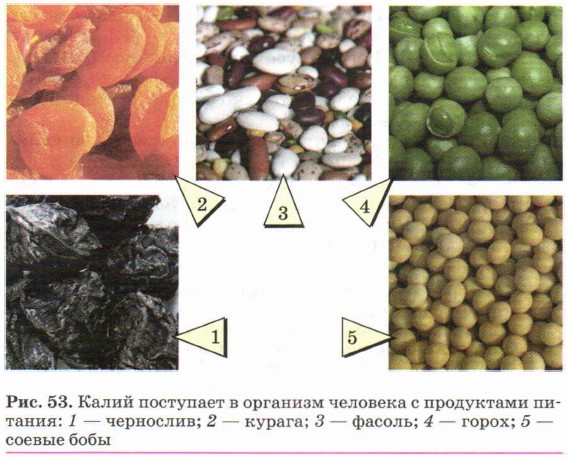
Больше всего калия содержат курага, соя, фасоль, зелёный горошек, чернослив, изюм и некоторые другие продукты (рис. 53).
Соли калия широко используют в сельском хозяйстве в качестве калийных удобрений.
Соли натрия, как и сам натрий, окрашивают пламя в жёлтый цвет, а калий и его соли — в розово-фиолетовый.
Щелочноземельные металлы
Щелочноземельными металлами называют 4 химических элемента IIA группы Периодической системы Д. И. Менделеева, начиная с кальция:
кальций Ca, стронций Sr, барий Ba, радий Ra.
 2020-06-10
2020-06-10 316
316







