Na2S2O3 + H2SO4 = Na2SO4 + H2O + SO2 + S↓
Цель работы:
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
Часть 1. Исследование зависимости скорости реакции от концентрации тиосульфата натрия при постоянных температуре и концентрации серной кислоты. Определение порядка реакции по тиосульфату натрия.
v = kC c xC к y; C к – const.
Т а б л и ц а 1
Зависимость скорости реакции от концентрации.
Результаты измерений и расчетов
| № | С с моль/л | V с | V вода | V к | t | v |
| см3 | см3 | см3 | с | С –1 | ||
| 1 | ||||||
| 2 | ||||||
| 3 | ||||||
| 4 |
V воды =20 – V c;
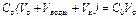 ; C c0 = 0,5 моль/л.
; C c0 = 0,5 моль/л.
Студент(ка)__________________
Группа________Дата__________
Рис. 1_________________________________________________________________________________________________________________________________________________________________________
Вывод: _______________________________________________________________
______________________________________________________________________
Часть 2. Исследование зависимости скорости реакции от температуры при постоянных концентрациях реагентов. Определение энергии активации реакции Ea и температурного коэффициента Вант–Гоффа γ.
C c = ___ моль/л; V с = ___ мл; V воды = ___ мл; V к = ___ мл.
Т а б л и ц а 2
Зависимость скорости реакции от температуры.
Результаты измерений и расчетов
| № | t | T | 1/ T | t | v | ln v |
| °C | K | K–1 | С | с–1 | – | |
| 1 | ||||||
| 2 | ||||||
| 3 | ||||||
| 4 |
Рис. 2
________________________________________________________________________________________________________________________________________________________________________________________
v 1 =__, v 2=__, v 3=__, v 4= __
γ1 = v 2/ v 1 =
γ2 = v 3/ v 2 =
γ3 = v 4/ v 3 =
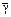 =
=
Вывод:________________________________________________________________
__________________________________________________________________________________________________________________________________________________________________________________________________________________
Студент(ка)__________________
Группа________Дата__________
Рис. 3
____________________________________________________________________________________________________________________________________________________________________________________________________
Точка 1: (____; –4);
Точка 2: (____; –3)
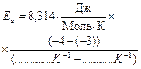
Вывод:_________________________
___________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
 2020-06-10
2020-06-10 92
92








