Атом состоит из ядра и электронной оболочки. Размер атома определяется электронной оболочкой и примерно равен 10–10 м. Ядро – центральная массивная часть атома, расположено в центре атома и имеет размеры порядка 10–15 м. Следовательно, размер ядра меньше атома примерно в 105 раз. Ядро состоит из очень маленьких частиц - протонов и нейтронов. Протон несет один положительный элементарный электрический заряд, а электрический заряд нейтрона равен нулю. Между этими частицами в любых парных комбинациях действуют ядерные силы, не зависящие от их электрического заряда, которые обеспечивают связь отдельных частиц с ядром. Поэтому в ядерной физике используют обобщающий термин нуклон, обозначающий любую из частиц, входящую в состав ядра, - как протон, так и нейтрон. Позднее будет показано, что протон и нейтрон это два состояния одной частицы.
Число нуклонов в ядре определяется массовым числом, которое обозначается буквой А. Массовое число – всегда целое число. Число протонов в ядре обозначается буквой Z. Кроме этого Z – число электронов в атоме с ядром, имеющим Z протонов, поскольку атом является электрически нейтральным. Химические свойства элементов определяются числом внешних электронов в атоме, а заполнение электронных оболочек приводит к периодичности в расположении атомов, то Z есть также порядковый номер или атомный номер элемента в периодической таблице Менделеева. Число нейтронов в ядре обозначают буквой N. Следовательно, число нейтронов в ядре N = A – Z. Любая из трех пар чисел (Z,N), (N,A) или (A,Z) однозначно определяет состав ядра. Обычно, по причинам, которые будут указаны ниже, используют пару чисел (А,Z).
1). Протон p+. Открыт в 1919 г. Резерфордом.
Заряд положительный e = 1,602 · 10 – 19 Кл
Различие в величинах заряда протона и электрона не превышает 10– 21 от величины e.
Масса mp = 1,672 · 10 – 27 кг = 1836,2 me
Масса также может быть выражена в энергетических единицах
mp = 938,3 МэВ
Спин s = ½ в единицах  , проекция спина sz =
, проекция спина sz =  ½
½
Волновая функция ассиметричная.
Дипольный момент у протона отсутствует.
Собственный магнитный момент протона равен:
 где
где  - ядерный магнетон.
- ядерный магнетон.
Собственный магнитный момент протона существенно отличается от ядерного магнетона, что свидетельствует о его сложной структуре.
Протон относится к группе адронов и поэтому участвует во всех видах взаимодействий.
Протон стабильная частица, оценка времени жизни τe > 6,5 ·1031 лет.
2). Нейтрон. Открыт в 1932 г. Чедвиком.
Заряд нейтрона равен нулю. Оценка  .
.
Масса mn = 1,675 · 10 – 27 кг = 1838,7 me
Масса также может быть выражена в энергетических единицах
mn = 939,6 МэВ
Спин s = ½ в единицах  , проекция спина sz =
, проекция спина sz =  ½
½
Волновая функция ассиметричная.
Дипольный момент у нейтрона равен нулю.
Собственный магнитный момент протона равен:
 .
.
Отношение магнитных моментов нейтрона и протона равно:

Собственный магнитный момент нейтрона, как и протона, существенно отличается от ядерного магнетона, что свидетельствует о его сложной структуре.
Нейтрон относится к группе адронов и поэтому участвует во всех видах взаимодействий.
Рассмотрим теперь закономерности в формировании ядер. Атомы, ядра которых имеют конкретные значения A и Z, называются нуклидами. Для обозначения нуклида используют две формы записи: (Z Х А ) или 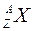 , где Х - символ химического элемента, атомы которого имеют соответствующее ядро. Например, (6 C12) или -
, где Х - символ химического элемента, атомы которого имеют соответствующее ядро. Например, (6 C12) или -  соответствующий нуклид углерода. Поскольку символ химического элемента однозначно связан с Z, то часто атомный номер в форме записи с указанием символа химического элемента опускают и пишут просто 12C. Такие же обозначения используются и для ядер.
соответствующий нуклид углерода. Поскольку символ химического элемента однозначно связан с Z, то часто атомный номер в форме записи с указанием символа химического элемента опускают и пишут просто 12C. Такие же обозначения используются и для ядер.
Атомы, ядра которых имеют в своем составе одинаковое число протонов Z, но различающиеся числом нуклонов A, называются изотопами химического элемента. Вещества, имеющие в своем составе атомы изотопов, имеют одинаковые химические свойства, но различную плотность, температуру плавления, кипения и пр., т.е. различаются физическими свойствами. Например: изотопы водорода. 1Н – протий (легкий водород); 2Н – дейтерий (тяжелый водород, для ядра употребляют также символ d); 3Н – тритий (сверхтяжелый водород, для ядра употребляют также символ t). 233U, 235U, 238U – изотопы урана. Однако об изотопе имеет смысл говорить, подразумевая его принадлежность к химическому элементу. Поэтому 235U – делящийся нуклид урана, а не делящийся изотоп урана. Таким же образом 3Н – радиоактивный нуклид водорода, а не радиоактивный изотоп, так как и в этом случае подразумеваются физические характеристики ядра, а не соответствующие химические свойства атома.
Нуклиды, ядра которых имеют одинаковое число нуклонов (одинаковое массовое число А), но различное число протонов Z, называют изобарами. Например: 3Н и 3Не - изобары трития и гелия, 10Ве, 10В, 10С - изобары бериллия, бора и углерода.
Нуклиды с одинаковым числом нейтронов в составе ядра называют изотонами. Например, 2Н и 3Не - изотоны водорода и гелия.
Все существующие ядра можно разделить на две большие группы:
- стабильные ядра;
- нестабильные ядра, подверженные радиоактивному распаду.
 2020-06-10
2020-06-10 178
178








