Особенности электронного строения металлов.
Металлы - это химические элементы, атомы которых отдают электроны внешнего (а иногда предвнешнего) электронного слоя, превращаясь в положительные ионы. Металлы – восстановители Ме0 – nе = Меn+. Это обусловлено небольшим числом электронов внешнего слоя (у металлов главных подгрупп в основном 1 – 3, у металлов побочных подгрупп 2, 1.), большим радиусом атомов, вследствие чего эти электроны слабо удерживаются с ядром.
Положение металлов в ПСХЭ.
Легко увидеть, что большинство элементов ПСХЭ – металлы (92 из 114).
Металлы размещены в левом нижнем углу ПСХЭ. Это все элементы, расположенные ниже диагонали В – Аt, даже те у которых на внешнем слое 4 электрона (Je, Sn, Pb), 5 электронов (Sb, Di), 6 электронов (Po), так как они отличаются большим радиусом. 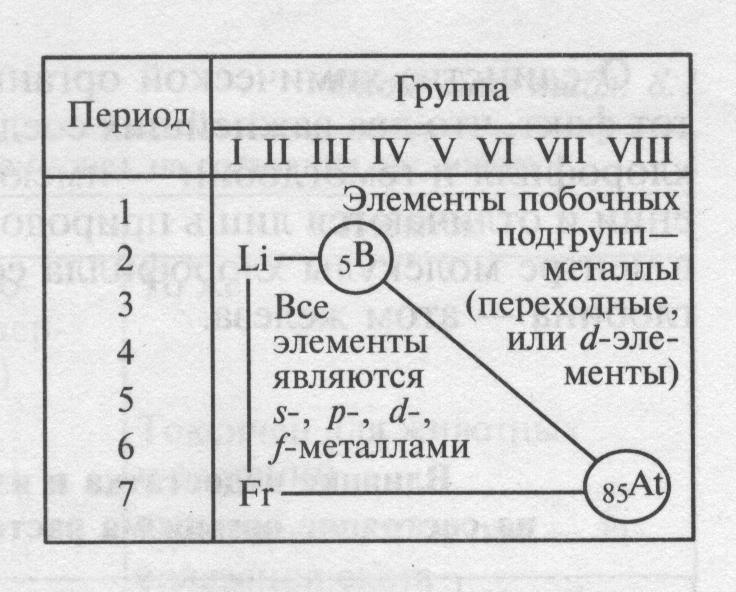 Среди них есть s и p-элементы – металлы главных подгрупп, а также d и f металлы, образующие побочные подгруппы.
Среди них есть s и p-элементы – металлы главных подгрупп, а также d и f металлы, образующие побочные подгруппы.
В соответствии с местом, занимаемым в периодической системе, различают переходные (элементы побочных подгрупп) и непереходные металлы (элементы главных подгрупп). Металлы главных подгрупп характеризуются тем, что в их атомах происходит последовательное заполнение электронных s- и р-подуровней. В атомах металлов побочных подгрупп сперва запоняется последний уровень, а далее происходит достраивание d- и f-подуровней предпоследнего уровня. У металлов глвных подгрупп сверху вниз металлические свойства (восстановительные свойства) усиливаются
, а у элементов – металлов побочных подгрупп свойства чуть-чуть другие.
В побочных подгруппах (Cu, Ag, Au) – активность элементов – металлов падает. Эта закономерность наблюдается и у элементов второй побочной подгруппы Zn, Cd, Hg. У элементов побочных подгрупп – это элементы 4-7 периодов – с увеличением порядкового элемента радиус атомов изменятся мало, а величина заряда ядра увеличивается значительно, поэтому прочность связи валентных электронов с ядром усиливается, восстановительные свойства ослабевают.
В то же время у металлических элементов B-групп (побочных) прослеживаются и некоторые общие для них закономерности, такие как:
1. В отличие от металлов главных подгрупп с постоянной валентностью и степенью окисления, большинство d-металлов имеют переменную валентность и переменную степень окисления.
2. В отличие от металлов главных подгрупп у металлов побочных подгрупп степень окисления может совпадать с номером группы; например Os в соединениях может проявлять максимальная степень окисления +8; у металлов главных подгрупп с.о от +1 до +3;
3. Соединения d-элементов могут проявлять как основные, так и кислотные свойства, а у металлов главных подгрупп свойства основные. Соединения с невысокими степенями окисления являются восстановителями, а соединения с высокими степенями окисления – окислителями; При увеличении степени окисления металла основной характер оксидов и гидроксидов ослабляется, а кислотный характер усиливается.
Физические свойства металлов
В соответствие именно с таким строением металлы характеризуются общими физическими свойствами.
а) твердость – все металлы кроме ртути, при обычных условиях твердые вещества. Самые мягкие – натрий, калий. Их можно резать ножом; самый твердый хром – царапает стекло.
б) плотность. Металлы делятся на легкие (до 5г/см³) и тяжелые (более 5г/см³).
в) плавкость. Металлы делятся на легкоплавкие и тугоплавкие.
г) электропроводность, теплопроводность металлов обусловлена их строением. Хаотически движущиеся электроны под действием электрического напряжения приобретают направленное движение, в результате чего возникает электрический ток.
При повышении температуры амплитуда движения атомов и ионов, находящихся в узлах кристаллической решетки резко возрастает, и это мешает движению электронов, и электропроводность металлов падает.
д) металлический блеск – электроны, заполняющие межатомное пространство отражают световые лучи, а не пропускают как стекло. Поэтому все металлы в кристаллическом состоянии имеют металлический блеск. Для большинства металлов в ровной степени рассеиваются все лучи видимой части спектра, поэтому они имеют серебристо-белый цвет. Только золото и медь в большой степени поглощают короткие волны и отражают длинные волны светового спектра, поэтому имеют желтый цвет. Самые блестящие металлы – ртуть, серебро, палладий. В порошке все металлы, кроме Al и Mg, теряют блеск и имеют черный или темно-серый цвет.
е) пластичность. Механическое воздействие на кристалл с металлической решеткой вызывает только смещение слоев атомов и не сопровождается разрывом связи, и поэтому металл характеризуется высокой пластичностью.
Некоторые металлы, например, железо, титан, олово и др. способны по достижении определенных температур изменять кристаллическое строение. Это явление получило название аллотропии или полиморфизма, а сами переходы от одного кристаллического строения к другому называются аллотропическими или полиморфными.
 2020-06-10
2020-06-10 210
210







