Гидролиз соли- взаимодействие ионов соли с молекулами воды. При гидролизе происходят изменения активной реакции среды, т.е. значение рН.
Типы:
1) Гидролиз соли образованный слабым основанием, сильной кислотой- это гидролиз «по катиону». Чтобы провести гидролиз до конца, нужно добавить в раствор ионы гидроксо-групп. Чтобы подавить гидролиз, ужно добавить в раствор один из продуктов гидролиза, т.е. кислоту.
Пример гидролиза: CuCL2 + HOH=CuOHCL+HCL
Cu+2+HOH=CuOH+ + H+, pH<7.
2) Гидролиз соли, образованной слабой кислотой и сильным основанием:
Na2CO3 + HOH= NaHCO3 + NaOH
СО32- + НОН= НСО3- + ОН-, рН>7.
3) Гидролиз соли, образованной слабой кислотой и слабым основанием. Практически идет сразу и до конца:
2Al2(CO3)3 + 6HOH= 4Al(OH)3 + CO2, рН=7
Pb(CH3COO)2 + HOH= Pb(OH)CH3COO + СН3СООН
Здесь гидролизу подвергается и катион и анион. Параллельно протеают 2 процесса:
Pb2+ +HOH= PbOH+ + H+ ; СН3СОО- +НОН= СН3СООН + ОН-
Если Ккисл=Косн, то катион и анион гидролизуются в равной степени и реакция раствора –нейтральная.
Если Ккисл>Косн, то катион соли гидролизуется в большей степени, чем анион,следовательно концентрация Н >концентрации ОН, реакция раствора слабокислая.
Если Ккисл<Косн, то гидролизу подвергается анион соли и реакция раствора слабощелочная.
-гидролиз соли, образованной слабой кислотой и сильным основанием, характеризуется константой гидролиза Кг
Кг=([ОН-][НА])/[А-]=Kw/Kкисл
Kw-ионное произведение воды
Чем слабее кислота, тем больше константа гидролиза
-для соли слабого основания MeОН и сильной кислоты
Кг=([Н+][МеОН])/[Ме+]=Kw/Косн
Чем слабее основание, тем Kг больше
Степень гидролиза-доля электролита, подвергшаяся гидролизу, она характеризиуется отношением числа гидролизировавшихся молекул соли к числу исходных молекул соли
Kг=(h^2 * C)/1-h
Чаще всего h<<1=>в знаменателе этой величиной можно пренебречь
Kг=h2 * C => степень гидролиза тем больше, чем меньше ее концентрация
h= 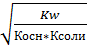 , соль, образованная сильным основанием и сильной кислотой
, соль, образованная сильным основанием и сильной кислотой
h=  – соль, образованная сильной кислотой и слабым основанием
– соль, образованная сильной кислотой и слабым основанием
h/(1-h)= 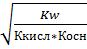 - соль слабой кислоты и слабого основания
- соль слабой кислоты и слабого основания
Таким образом, количественно реакция гидролиза характеризуется Кг и степенью гидролиза.
 2020-07-12
2020-07-12 180
180








