На ряду  неметаллические и окислительные свойства ослабевают.
неметаллические и окислительные свойства ослабевают.
F:
o Получение в лаборатории:  .
.
o Реагирует:
· Со всеми металлами:  .
.
· С неметаллами: 
· При нагревании с другими галогенами:  .
.
· Окисляет воду: 
o Соединение с водородом – фтороводород:
· Получение: 
· Реагирует с оксидами металлов: 
· В водном растворе плавиковая кислота – кислота средней силы, реагирующая со многими металлами: 
Cl:
o Получение в лаборатории:  .
.
o Реагирует:
· Со всеми простыми веществами, за исключением O,Nи благородных газов: 
· Со сложными веществами: 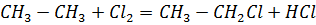
· При нагревании вытесняет бром или иод: 
· С водой: 
· Со щелочами: 
o Соединение с водородом – хлороводород:
· Получение: 
· В водном растворе соляная кислота – сильная одноосновная кислота, реагирующая:
§ С металлами: 
§ Cоксидами металлов: 
§ С окислителями, т.е. обладает восстановительными свойствами: 
Br:
o Получение в лаборатории: 
o Реагирует:
· С водой: 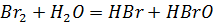
· Cорганическими соединениями: 
· Со щелочами: 
o Соединение с водородом – бромоводород:
· Получение: 
· Водный раствор бромная кислота – сильная одноосновная кислота, реагирующая:
§ С металлами: 
§ Cоксидами металлов: 
§ Со щелочами: 
§ Cокислителями,т.е. обладает восстановительными свойствами: 4 
I:
o Получение в лаборатории: 
o Реагирует:
· С металлами: 
· С водой: 
o Соединения с водородом – иодоводород:
· Получение: 
· Способен к окислению: 
· Реагирует с органическими соединениями: 
Atреагирует с металлами: 
Можно ли получит карбонат хрома при сливании растворов нитрата хрома и карбоната натрия?
Нет, при сливании растворов нитрата хрома и карбоната натрия получится: 
Карбонат хрома в лаборатории не получен, т.к. он слишком неустойчив из-за необратимого гидролиза.
4) Определите концентрации H+и ОН- в растворе, водородный показатель которого равен 9,1.
Дано:
рН=9,1
Найти 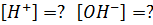
Решение:
Для нахождения концентраций используем формулы:

Но рОН не известен. Его находим по формуле: 
Вычисляем конечный ответ:
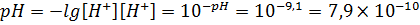

Билет №29
1) Химические реакции можно разделить на необратимые, направление которых не зависит от внешних условий, и обратимые, направление которых может изменяться в зависимости от температуры, концентрации и давления. Обратимыми могут называться реакции, которые в рассматриваемых условиях могут протекать как в прямом, так и в обратном направлениях. Рассмотрим обратимую реакцию в общем виде:
 mA+nBpC+qD
mA+nBpC+qD

 Применив закон действующих масс к прямой и обратной реакции, получим:
Применив закон действующих масс к прямой и обратной реакции, получим:
V1= k1*CAm *CBn V2=k2*CCp *CDq
Где V1 и V2–скорости прямой и обратной реакции.

 По мере протекания реакции концентрация исходных веществ уменьшается, и скорость прямой реакции убывает, а скорость обратной реакции возрастает вследствие увеличения концентрации полученных веществ. Наконец наступает момент, когда скорость обратного процесса становится равной скорости прямого, то есть V1 =V2.
По мере протекания реакции концентрация исходных веществ уменьшается, и скорость прямой реакции убывает, а скорость обратной реакции возрастает вследствие увеличения концентрации полученных веществ. Наконец наступает момент, когда скорость обратного процесса становится равной скорости прямого, то есть V1 =V2.
Состояние системы, при котором скорость прямой реакции равна скорости обратной, называется химическим равновесием, а концентрации всех четырех веществ – равновесными концентрациями.
Химическое равновесие характеризуется постоянством энергии Гиббса системы Gr,v.
Равенство Gr=0 является термодинамическим условием химического равновесия. Константа равновесия связана со стандартной энергией Гиббса данной реакции соотношением:
 Gr=-RTlnK
Gr=-RTlnK
R-универсальная газовая постоянная(8,31 Дж/моль*К)
Т-абсолютная температура, К
К-константа равновесия.
Химическое равновесие остается неизменным пока остаются постоянными параметры, при которых оно установилось. При изменении условий равновесие нарушается. Смещение равновесия в зависимости от изменения концентраций реагирующих веществ, температуры, давления в общем виде определяется принципом Ле-Шателье: если в системе, находящейся в равновесии, изменить одно из условий, то происходит смещение равновесия в направлении той реакции, которая противодействует произведенному изменению.
Равновесие смещается в ту или иную сторону потому, что изменение условий по-разному влияет на скорость прямой и обратной реакции. Равновесие смещается в сторону той реакции, скорость которой при нарушении равновесии становится больше.
Согласно принципу Ле-Шателье:
1. Увеличению концентрации одного из исходных веществ смещает равновесие в сторону протекания прямой реакции (скорость прямой реакции становится больше скорости обратной), увеличение же концентрации продуктов реакции - в сторону обратной реакции. Например,при увеличении концентрации FeCL3 и NH4CNSравновесие в системе:
 FeCL3 + 3NH4CNSFe(CNS)3 + 3NH4CL
FeCL3 + 3NH4CNSFe(CNS)3 + 3NH4CL
Смещается вправо, а при увеличении концентрации NH4CL – влево.
2. При увеличении давления равновесие смещается в сторону образования меньшего числа моль газа, т.к. они занимают меньший объем.
3. Повышение температуры смещает равновесие в сторону эндотермической реакции, понижение – в сторону экзотермической реакции.
Соединения серебра, их растворимость,кислотно-основные и ОВ характеристики. Бактерицидные свойства иона серебра. Комплексные соединения серебра с галогенидами, аммиаком, тиосульфатами.
Оксид аргентума(Ag2O -темнобурый) почти нерастворим в воде и обладает амфотерным характером с преобладанием основных свойств. При нагревании оксид разлагается с выделением кислорода: 2Ag2O=4Ag+O2
Гидроксид серебра (1) малорастворим в воде, термически неустойчив, легко отщепляет воду,передодя в оксид.
2AgNO3+ 2NaOH= Ag2O +H2O+NaNO3
В растворах галогенводородных кислот оксиды и гидроксиды меди образуют соли типа МеГ или МеГ2 и ацидокомплексы:
Ag2O+2HCl=2AgCl +H2O
AgCl+ HCl=H[AgCl2]
Комплексные соединения серебра большей чатью хорошо растворимы в воде, поэтому реациикомплексообразования часто используют для перевода таких малорастворимых солей в раствор.Например хлориды серебра ратворяются в водном растворе аммиака:
AgCl+2NH3=[Ag(NH3)2]Cl
При действии азотной кислоты на хлорид диаминсеребравыпадаетт осадок AgClв следствие связывания NH3 в NH4+:
[Ag(NH3)2]Cl +HNO3=AgCl+2NH4NO3
Галогениды серебра (1) легко образуют комплексы с S2O3uCN: [Ag(S2O3)2]-3, [Ag(CN)2]-. Например: AgCN+KCN=K[Ag(CN)2] с концентрированными галогеноводородами кислотами дают комплексные анионы [AgI2]-; растворимы в галогенилах щелочных металлов:
AgI+KI=K[AgI2]
Ионы серебра, проявляют свойства окислителя: 2AgNO3+H2O2+2KOH=2Ag+O2+2KNO3+2H2O
 2020-07-12
2020-07-12 248
248








