Цинк и кадмий входят во IIB или 12 группу элементов. Единственная степень окисления, которую эти элементы проявляют в своих соединениях, является степень окисления +2.
На воздухе цинк и кадмий покрываются оксидной пленкой, которая защищает их от дальнейшего окисления. Оксидная пленка препятствует вытеснению цинком или кадмием водорода из воды, однако, при нагревании такие реакции идут.
В разбавленныхHCl и H2SO4 цинк растворяется легко, а кадмий медленно.
Me + 2H+ → Me2+ + H2
Кислоты – окислители растворяют оба эти металла. При этом Zn восстанавливают серную кислоту до серы или H2S, а Cd — до SO2.
4Zn + 5H2SO4 (конц.) → 4ZnSO4 + H2S↑ + 4H2O
Cd + 2H2SO4(конец.) → Cods + SO2↑ + 2H2O
При действии азотной кислоты на металл происходит образование различных продуктов ее восстановления:
Э + 8HNO3(конец.) = Э(NO3)2 + 2NO + 4H2O
4Zn + 10HNO3 (5%.) = 4Zn(NO3)2 + NH4NO3 + 3H2O
3Cd + 8HNO3 (5%.) = 3Cd(NO3)2 + 2N2O + 4H2O
Восстановительные свойства цинка и кадмия проявляются также и при их взаимодействии с сильными окислителями такими, как перманганат калия или ванадат натрия. При взаимодействии с перманганатом калия в кислой среде происходит обесцвечивание раствора в
результатереакции:
5Me + 2KMnO4 + 8H2SO4 = 2MnSO4 + 5MeSO4 + K2SO4 + 8H2O
При взаимодействии цинка или кадмия с ванадатом натрия в кислой среде происходит последовательное восстановление ванадат иона по схеме:
VO3- → VO2+ → V3+ → V2+
Т.е. последовательно идут следующие реакции:
Me + 2NaVO3 + 4H2SO4 = MeSO4 + 2(VO)SO4 + Na2SO4 + 4H2O
Me + 2MeVO3 + 6H2SO4 = V2(SO4)3 + 3MeSO4 + 6H2O
Me + V2(SO4)3 = 2VSO4 + MeSO4
Цвет раствора при этом меняется от желтого (VO3-) до синего (VO2+), затем до зеленого (V3+) и до фиолетового (V2+).
Металлический цинк способен растворяться в концентрированных растворах щелочей вследствие амфотерности своего гидроксида. Кадмий такой способностью не обладает.
Zn + 2KOH + 2H2O = K2[Zn(OH)4] + H2
Оксиды MeО цинка и кадмия можно получить не только синтезом из простых веществ, но и термическим разложением гидроксидов, карбонатов или нитратов.
Э(OH)2 = ЭO + H2O↑
ЭCO3 = ЭO + CO2↑
2Э(NO3)2 = 2ЭO + 4NO2↑ + O2↑
Оксид цинка обладает амфотерными свойствами, а оксид кадмия - основными свойствами. Оба оксида при взаимодействии с кислотами образуют аквакомплексы с координационными числами 4 для цинка и 6 для кадмия: [Zn(H2O)4]2+, [Cd(H2O)6]2+. Со щелочами взаимодействует
только оксид цинка с образованием гидроксокомплекса [Zn(OH)4]2-.
Гидроксиды цинка и кадмия получают косвенным путем, при взаимодействии растворимых солей элементов со щелочью:
Э2+ + OH- = Э(OH)2
Гидроксид кадмия обладает основными свойствами и взаимодействует только с кислотами, а гидроксид цинка проявляет амфотерные свойства и легко растворяется как в кислотах, так и в щелочах, образуя комплексные гидроксоцинкаты [Zn(OH)4]2-.
Гидроксиды цинка и кадмия способны растворяться в водном растворе аммиака за счет
образования комплексов [Zn(NH3)4]2+ или [Cd(NH3)6]2+.
Соли цинка и кадмия гидролизуются. В наибольшей степени гидролизу подвергаются соли цинка. Вследствие этого взаимодействие металлического цинка с подогретым раствором
газообразного водорода.
[Zn(H2O)4 ]2+ + H2O⇔ [ZnOH(H2O)3 ]+ + H3O+
Zn + H3O+ = Zn2+ + H2↑ + H2O
Добавление в растворы солей цинка и кадмия карбонат иона приводит к образованию малорастворимых основных карбонатов цинка или кадмия.
2Э2+ + 2H2O + CO32- = (ЭOH)2CO3↓ + 2H+
Почему HNO3 относится к сильным кислотам окислителям?

Билет №28
1) Закон химического равновесия (действующих масс). Константа химического равновесия. Ее связь со стандартным изменением энергии Гиббса процесса.
Закон действующих масс устанавливает отношение между массами реагирующих веществ в химических реакциях при равновесии, а также зависимость скорости химической реакции от концентрации исходных веществ.
В химической термодинамике ЗДМ определяет константу химического равновесия.
Константа равновесия – это отношение произведения равновесных концентраций продуктов химической реакции на произведение равновесных концентраций исходных веществ, взятые в степенях их стехиометрических коэффициентов.
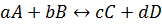
Для этой реакции: 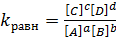
Связь со стандартным изменением энергии Гиббса.
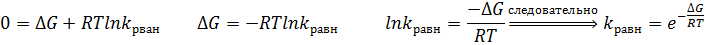
Из этого уравнения следует, что Кравн при данной температуре зависит только от стандартного изменения энергии Гиббса.
 2020-07-12
2020-07-12 757
757








