Большинство задач по химии связано с расчётами по уравнениям реакций. Остановимся на некоторых особенностях составления алгебраических уравнений и неравенств при решении подобных задач.
Алгебраические уравнения составляют на основе уравнений реакций. Последние дают представление о стехиометрических отношениях взаимодействующих и образующихся в реакции веществ. Чаще всего алгебраические уравнения составляют, учитывая соотношение количеств веществ соединений, участвующих в реакции, и используя зависимость n = m / M, где М – молярная масса (в г/ моль). Иногда алгебраические уравнения записывают в виде равенства масс определённого химического элемента в соединениях, вступивших в реакцию, и в конечных продуктах. Для однозначного решения задачи число уравнений должно равняться числу неизвестных величин, фигурирующих в уравнениях.
Задача № 1. При сгорании смеси муравьиной, уксусной и щавелевой кислот образуется 2,016 л углекислого газа (н.у.). На нейтрализацию такой же смеси кислот требуется 200 г 1,4%-ного раствора гидроксида натрия. Найти массу уксусной кислоты в исходной смеси.
Уравнения реакций сгорания муравьиной, уксусной и щавелевой кислот:
х х
2Н СООН + 
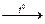
 2С
2С  + 2
+ 2  О
О  (1)
(1)
у 2у
С  СООН + 2
СООН + 2 
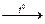
 2С
2С  +
+  2
2  О
О  (2)
(2)
z 2z
2 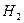

 +
+ 
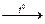
 4С
4С  + 2
+ 2  О
О  (3)
(3)
Уравнения реакции нейтрализации кислот:
x x
НСООН + NaOH 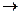 HCOONa +
HCOONa +  О
О  (4)
(4)
y y
С  СООН + NaOH
СООН + NaOH 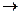 С
С  СООNa +
СООNa +  О (5)
О (5)
 z 2z
z 2z
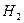

 + 2 NaOH
+ 2 NaOH 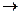


 + 2
+ 2  О
О  (6)
(6)
Рассчитаем количества: а) С  образующегося в результате реакций (1-3); б) NaOH, требующегося для реакции (4-6):
образующегося в результате реакций (1-3); б) NaOH, требующегося для реакции (4-6):
n (С  ) =2, 016/ 22,4= 0,09 моль
) =2, 016/ 22,4= 0,09 моль
n (NaOH) =  = 0,07 моль
= 0,07 моль
Пусть в исходной смеси n (НСООН) = x, n (С  СООН) = у и
СООН) = у и
n (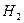

 ) = z. Тогда, согласно уравнениям (1-6),
) = z. Тогда, согласно уравнениям (1-6),

 (С
(С  ) = n (HCOOH) = х,
) = n (HCOOH) = х,
 (С
(С  ) = 2n (С
) = 2n (С  СООН) = 2y, x + 2y + 2z = 0, 09
СООН) = 2y, x + 2y + 2z = 0, 09
 (С
(С  ) = 2n (
) = 2n (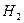

 ) =2 z
) =2 z
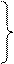
 (NaOH) = n (HCOOH) = x
(NaOH) = n (HCOOH) = x
 (NaOH) = n) (С
(NaOH) = n) (С  СООН) = у, x + y + 2z = 0, 07
СООН) = у, x + y + 2z = 0, 07
 (NaOH) = 2n (
(NaOH) = 2n (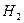

 ) =2z
) =2z
Получим систему из двух уравнений с тремя неизвестными:
x + 2y + 2z = 0, 09
x + y + 2z = 0, 07
Вычтем из первого уравнения второе:
2у – у = 0, 02; у = 0,02
m (С  СООН) =
СООН) =  = 1,2 г
= 1,2 г
Ответ: 1,2 г С  СООН.
СООН.
Задача № 2. При сгорании 10,0 г смеси предельного одноатомного спирта и его симметричного простого эфира образовалось 12,0 г воды. Определить состав и массы соединений в исходной смеси.
Решение: Напишем в условном виде уравнения реакций горения предельного одноатомного спирта и его симметричного эфир:
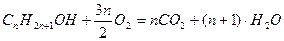 ,
,
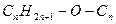
 ,
,
Искомые величины: n- число атомов углерода в молекуле спирта, х - масса спирта в смеси и (10-х)- масса эфира в смеси (в гаммах).
Составим уравнение, учитывая, что масса водорода в сожжённой смеси спирта и эфира равна массе водорода в образовавшейся воде:
х  , или
, или
 .
.
Для удобства решения сделаем подстановку: 2n + 2=у, тогда уравнение примет вид:
 (1), отсюда найдём:
(1), отсюда найдём:

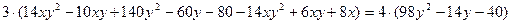
28y2-12xy + 24x – 124y -80 = 0
14y2- 6xy +12x -62y – 40 = 0
14y2 – 2y (3x + 31) + 12x - 40 = 0
y1, y2 =  , ay2 + 2my + c = 0
, ay2 + 2my + c = 0
у =  (2)
(2)
Из условия задачи следует также, что масса спирта в смеси находится в пределах (0-10) г, т.е. 0 < х <10. Подставив предельно возможные значения х в формуле (2),
При х = 0 у1=  = 5
= 5
У2 = -  , не имеет смысла,
, не имеет смысла,
получим при х=0, у =5 (отрицательное значение у не принимается во внимание). Поскольку у = 2n + 2, или 5 = 2n + 2, то n = 1,5.
При х=10 из формулы У1= 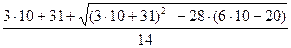 = 8,
= 8,
У2 = 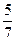 , (не имеет смысла)
, (не имеет смысла)
определим: у = 8; при подстановке этого значения в уравнение
у =2n + 2; 8 = 2n + 2 найдём n = 3.
Таким образом, 1,5 < n <3, значит n = 2. Следовательно, формула спирта C2H5OH и
эфира -C2H5-O-C2H5.
Для определения массы этилового спирта в смеси найдём у при n = 2, у =2n + 2; 6 = 2n + 2 -и подставим его в уравнение (1).

333х + 34,50- 345х = 34,04
- 12х = - 46
х = 3,83
Масса этилового спирта в смеси х = 3,83 г. Затем определим массу эфира: m (эфира) = 10-х =10-3,83 = 6,17 (г).
Ответ: Смесь содержала 3,83 г этилового спирта и 6,17 г диэтилового эфира.
Задача № 3. При нагревании 2,9 г нитрата щелочного металла образовалось 2,44 г нитрита металла и кислород. Написать формулу нитрата металла.
Решение:
2МеN 
 2MeN
2MeN  +
+ 
Неизвестная искомая величина М (Ме)- молярная масса металла. Составим уравнение, учитывая, что количество молей нитрата металла равно количеству молей нитрита металла:
n (МеN  ) = n (MeN
) = n (MeN  )
)

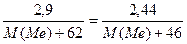 M (Me)= 39
M (Me)= 39  → Me- калий
→ Me- калий
Ответ: K N  .
.
Задача № 4. При взаимодействии 2,45 г смеси перманганата калия и оксида марганца (IV) с избытком соляной кислоты образовалось 2,485 г хлора. Вычислить массовые доли компонентов в смеси.
Решение:
x г у г
KMn  + 16 HCL = 5
+ 16 HCL = 5  + 2KCL + 2Mn
+ 2KCL + 2Mn  + 8
+ 8  (1)
(1)
158 г 5  г
г
(2,45-x)г (2,485-у)г
Mn  + 4HCL = Mn
+ 4HCL = Mn  +
+  + 2
+ 2  (2)
(2)
87г 71 г
Пусть х г – m (KMn  ), тогда (2,45-х) г- m (Mn
), тогда (2,45-х) г- m (Mn  );
);
у г- m ( ) в реакции (1); тогда (2,485-у) г- m (
) в реакции (1); тогда (2,485-у) г- m ( ) в реакции (2).
) в реакции (2).
Составим систему уравнений с двумя неизвестными:

 , у = 2,2468
, у = 2,2468 
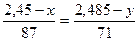
х = 0,339 г (KMn  ), m (Mn
), m (Mn  )= 2,45- 0,339= 2,11 г
)= 2,45- 0,339= 2,11 г
w (KMn  )=
)=  % =13,85 %
% =13,85 %
w (Mn  ) = 100 – 13,85= 86,15 %
) = 100 – 13,85= 86,15 %
Ответ: w (KMn  )= 13,85 %, w (Mn
)= 13,85 %, w (Mn  ) =86,15 %.
) =86,15 %.
Задача № 5. Имеется смесь железа, углерода и оксида меди (I) c молярным соотношением 1: 2: 5. Вычислить объем 96 % азотной кислоты (плотность 1.5 г/мл), необходимый для полного растворения 80 г такой смеси при нагревании, а также объем газов, выделившихся при этом (н.у.).
Продуктом восстановления азотной кислоты во всех случаях считать оксид азота (I V).
Решение.
Пусть n (Fe) = x, n (C) = 2x, n ( ) = 5x моль.
) = 5x моль.
По условию,
56х + 12 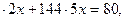 откуда х = 0.1
откуда х = 0.1
Уравнение реакций:
x 6x 3x

2x 8x 2x 8x
C + 4 
5x 30x 10x

Из уравнений реакций следует, что для полного растворения смеси нужно
6х + 8х + 30 х = 44х = 44  моль азотной кислоты.
моль азотной кислоты.
w (HNO3) = 
m (р-ра  ) = 4.4
) = 4.4  289 г
289 г
ρ =  , V =
, V = 
V (р-ра  ) = 289/1.5 = 193 мл.
) = 289/1.5 = 193 мл.
В первой реакции выделяется 0.3 моль  , во второй реакции 0.2 моль
, во второй реакции 0.2 моль 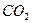 и 0.8 моль
и 0.8 моль 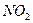 , в третьей реакции 0.1 моль
, в третьей реакции 0.1 моль  ,
,
т.е. всего выделяется (0.3 + 0.8 + 1) = 2.3 моль газов
V = n 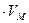
V (CM) = 2.3  л.
л.
Ответ: 193 мл 96% р-ра  , 51.5 л газов.
, 51.5 л газов.
Задача № 6. В стальной сосуд ёмкостью 2.75 л поместили 1.53 г предельной монокарбоновой кислоты, затем туда ввели 3.36 л кислорода (н.у.). После
Поджигания кислота полностью сгорела, при этом давление внутри сосуда при температуре 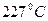 составило 306 кПа. Определить формулу кислоты.
составило 306 кПа. Определить формулу кислоты.
Решение:
Общая формула предельных монокарбоновых кислот 
M = 14n +46
Уравнение реакции горения выглядит следующим образом:
1.53/ (14n+46)= (3n+1)/2  (n+1) b (n+1) b
(n+1) b (n+1) b
=b моль моль моль
Cn+1H2n+2O2 + (3n + 1) / 2 O2 = (n + 1) CO2 + (n +1) H2O
Пусть 1.53/(14n +46) = b моль, тогда  - число молей кислорода,
- число молей кислорода,
(n +1) b – число молей углекислого газа и (n+1) b – число молей воды.
Поскольку кислород взят в избытке или в стехиометрическом количестве, то после реакции его останется (3.36/22.4 – (3n +1) 2b) моль.
Образовалось (n+1) b моль углекислого газа и (n +1) b моль воды (вода – газ!).
Вычислим число молей газов в конечной смеси по закону Клапейрона – Менделеева:
PV = n RT, n = PV/RT = 306  моль
моль
Таким образом, всего в конечной смеси содержится:
0,15- (3n +1)/2b +2 (n+1) b = 0.15 +(n/2 + 1.5) b = 0, 2025 (1)
Подставим в уравнение (1) b = 1.53/(14n +46),
0.15 + 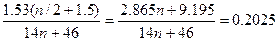 моль
моль
1,53n + 4,59 = 0,0525 (14n + 46) 2
0,06 n = 0,24
n = 4
Отсюда n = 4.
Таким образом, формула искомой кислоты - 
 .
.
Ответ:  .
.
 2020-07-12
2020-07-12 332
332








