(историю опускаю сознательно, но я бы назвал дату выделения первого белка, упомянул модель Поллинга и еще что-нибудь)
Классификация по функции
В соответствии с биологическими функциями выделяют:
- структурные белки (коллаген, кератин),
- ферментативные (пепсин, амилаза),
- транспортные (трансферрин, альбумин, гемоглобин),
- резервно-пищевые (белки яиц и злаков),
- сократительные и двигательные (актин, миозин, тубулин),
- защитные (иммуноглобулины, тромбин, фибриноген),
- регуляторные (соматотропный гормон, адренокортикотропный гормон, инсулин).
Классификация по строению
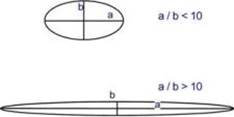
Сравнение формы глобул и фибрилл зависимости от формы молекулы выделяют глобулярные и фибриллярные белки. В глобулярных белках соотношение продольной и поперечной осей составляет менее 10 и в большинстве случаев не более 3-4. Эти белки характеризуются компактной трехмерной укладкой полипептидных цепей. Например: инсулин, альбумин, глобулины плазмы крови.
Фибриллярные белки имеют соотношение осей более 10. Они состоят из пучков полипептидных цепей, спиралью навитых друг на друга и связанные между собой поперечными ковалентными и водородными связями. Выполняют защитную и структурную функции. Например: кератин, миозин, коллаген.
По количеству белковых цепей в одной молекуле выделяют мономерные белки, которые имеют одну субъединицу (протомер) и полимерные белки, имеющие несколько субъединиц. Например, к мономерным белкам относятся альбумины, миоглобин, к полимерным - гемоглобин (4 субъединицы), ферменты лактатдегидрогеназа и креатинкиназа (4 и 2 субъединицы, соответственно), гексокиназа (2 субъединицы). Субъединицы в белке могут быть как одинакового, так и различного строения.
По химическому составу все белки подразделяют на простые и сложные. Простые белки содержат в структуре только аминокислоты (альбумины, глобулины, гистоны, протамины). Сложные белки, кроме аминокислот, имеют небелковые компоненты:
- нуклеопротеины,
- фосфопротеины,
- металлопротеины,
- липопротеины,
- хромопротеины,
- гликопротеины.
Основное различие между Пептидом и Белком состоит в том, что Пептид представляет собой короткую последовательность аминокислот с первичной структурой, тогда как Белок представляет собой полипептид, с гораздо большей структурой, имеющей различные уровни организации, такими как вторичная, третичная и четвертичная структура. Кроме того, пептидные связи возникают между аминокислотами в полипептидной цепи, в то время как различные полипептидные цепи белка связаны водородными связями и дисульфидными мостиками.
---
Физико-химические свойства белков. Растворимость белков в воде. Факторы устойчивости белковых растворов. Общие реакции на белки: цветные и осаждения. Использование этих реакций в медицинской практике.
К физико-химическим свойствам белков относят амфотерность, растворимость, способность к денатурации, коллоидные свойства.
Амфотерность
Так как белки содержат кислые и основные аминокислоты, то в их составе всегда имеются свободные кислые (СОО–) и основные (NH3+) группы.
Заряд белка зависит от соотношения количества кислых и основных аминокислот. Поэтому, аналогично аминокислотам, белки заряжаются положительно при уменьшении рН, и отрицательно при его увеличении. Если рН раствора соответствует изоэлектрической точке белка, то заряд белка равен 0.
Если в пептиде или белке преобладают основные аминокислоты (лизин и аргинин), то при нейтральных рН заряд белка положительный, т.к. обусловлен положительным зарядом радикала этих аминокислот.
Если в белке преобладают кислые аминокислоты (глутамат и аспартат), то белок кислый, при нейтральных рН заряд белка отрицательный и изоэлектрическая точка находится в кислой среде. Для большинства природных белков изоэлектрическая точка находится в диапазоне рН 4,8-5,4, что свидетельствует о преобладании в их составе глутаминовой и аспарагиновой аминокислот.
Растворимость
Так как большинство белков несет много заряженных групп, то в целом они водорастворимы. Растворимость объясняется:
- наличием заряда и взаимоотталкиванием заряженных молекул белка,
- наличием гидратной оболочки – окружение молекулы диполями воды и взаимодействие их с полярными и заряженными группами на поверхности глобулы белка. Чем больше полярных и/или заряженных аминокислот в белке, тем больше гидратная оболочка.

Устойчивость белковым растворам придают два фактора: заряд белковой молекулы и гидратная оболочка.
Заряд белковой молекулы.
Появление заряда на молекулах белков связано с его амфотерными свойствами (наличием кислотных и основных свойств). Группы, способные приобретать заряды, называются ионогенными. К ним относятся - СООН группы глютамата, аспартата, -NH2 группы лизина, аргинина, азот имидазольного кольца гистидина. В очень незначительной степени ионизируются -SH группы цистеина и -OH группы тирозина. Ионизация различных функциональных групп белка групп определяется рН среды.
Формирование гидратной (водной) оболочки
Белки обычно имеют такую пространственную укладку, при которой гидрофобные группы «прячутся» в глубине белковой молекулы, а гидрофильные находятся на поверхности молекулы. К гидрофильным группам относятся - СООН, -NH2, -SH, -ОН, пептидная связь, карбонильная группа. К гидрофильным группам притягиваются диполи Н2О, в результате чего вокруг белковой молекулы формируется защитная водная «шуба», которая препятствует склеиванию белковых молекул и осаждению их из растворов. Вода, входящая в состав гидратных оболочек, называется связанной водой. Она отличается по физическим свойствам и определяет биологическую активность биополимеров.
Колориметрические методы определения, основанные на цветных реакциях белков:
- методы, основанные на неспецифическом связывании красителя (простой абсорбции), достаточно чувствительны, но степень связывания красителя зависит от индивидуальных свойств белка (метод с кумасси бриллиантовым голубым).
- биуретовый метод — наиболее широко применяется в настоящее время, основан на специфической реакции пептидной связи с ионами меди в щелочной среде с образованием продукта фиолетового цвета. Существуют разные модификации этого метода с целью увеличения интенсивности окраски и ее стабильности, повышения устойчивости реактива. Например, тартрат добавляют как стабилизатор, который при комплексировании с ионами меди предотвращает их осаждение в щелочной среде, KJ предотвращает спонтанное восстановление щелочного тартрата меди и осаждение оксида меди и, следовательно, повышает устойчивость реактива. Чувствительность и специфичность метода зависит от используемой длины волны: 540-580 нм, 263 нм или 310 нм. Метод считается самым специфичным и точным, так как присутствие ароматических аминокислот, фенолов, мочевой кислоты не влияет на биуретовую реакцию.
- метод Лоури — основан на образовании вольфрамового синего и молибденового синего из фосфорномолибденовой и фосфорновольфрамовой солей реактива Фолина-Чикольте при взаимодействии их с ароматическими аминокислотами, в основном остатками тирозина, но определенный вклад дают триптофан, гистидин, цистеин. Максимум поглощения находится в диапазоне 745-750 нм. В составе рабочего реактива имеется биуретовый реактив, что позволяет определять также пептидные связи. К недостатку метода относится: во-первых, отрицательное влияние на развитие окраски веществ, используемых для выделения, очистки и солюбилизации белков (детергентов, компонентов буферных систем, сульфгидрильных и других восстанавливающих агентов, пуринов, глицина, сахарозы, сернокислого аммония и др); во-вторых, отсутствие линейной зависимости интенсивности окраски от количества белка-стандарта. Метод более чувствителен по сравнению с биуретовым, но специфичность его ниже, так как интенсивность окраски зависит от аминокислотного состава белка, а также от последовательности расположения аминокислот и степени экранирования функциональных групп.
---
 2020-07-12
2020-07-12 696
696








