Электрофорез белков
(на примере белков крови)
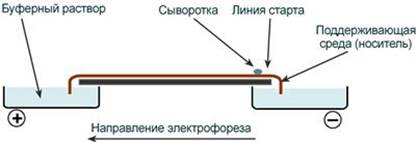
Ацетатцеллюлозная пленка, гель, специальная бумага (носитель) помещается на рамку, при этом противоположные края носителя свисают в кюветы с буферным раствором. На линию старта наносится сыворотка крови. Метод заключается в движении заряженых молекул белка по поверхности носителя под влиянием электрического поля. Молекулы с наибольшим отрицательным зарядом и наименьшим размером, т.е. альбумины, двигаются быстрее остальных. Наиболее крупные и нейтральные (γ-глобулины) оказываются последними.
На ход электрофореза влияет подвижность разделяемых веществ, находящаяся в зависимости от ряда факторов: заряд белков, величина электрического поля, состав растворителя (буферной смеси), тип носителя (бумага, пленка, гель).
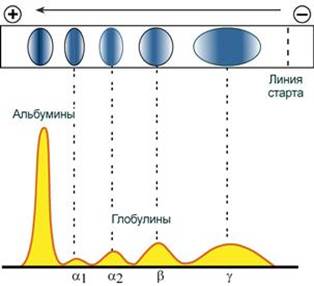
Количество выделяемых фракций определяется условиями проведения электрофореза. При электрофорезе на бумаге и пленках ацетата целлюлозы в клинико-диагностических лабораториях выделяют 5 фракций (альбумины, α1-, α2-, β- и γ-глобулины), в то время как в полиакриламидном геле – до 20 и более фракций. При использовании более совершенных методов (радиальная иммунодиффузия, иммуноэлектрофорез и других) в составе глобулиновых фракций выявляются многочисленные индивидуальные белки.
---
Первичная и вторичная структура белковой молекулы. Связи, стабилизирующие их. Особенности строения пептидной связи и их роль в формировании пространственной структуры белка. Виды вторичной структуры.
Первичная структура белков, т.е. последовательность аминокислот в нем, программируется последовательностью нуклеотидов в ДНК. Выпадение, вставка, замена нуклеотида в ДНК приводит к изменению аминокислотного состава и, следовательно, структуры синтезируемого белка.
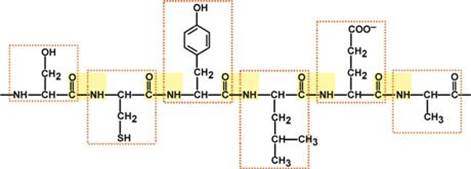
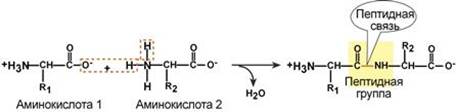
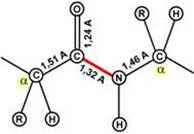
Пептидная связь – это связь между α-карбоксильной группой одной аминокислоты и α-аминогруппой другой аминокислоты.
К свойствам пептидной связи относятся:
1. Копланарность
Все атомы, входящие в пептидную группу находятся в одной плоскости, при этом атомы "Н" и "О" расположены по разные стороны от пептидной связи.
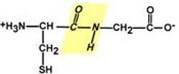
2.Транс-положение заместителей
Радикалы аминокислот по отношению к оси пептидной C—N-связи находятся по "разные" стороны, в транс-положении.
3. Две равнозначные формы
Пептидная связь находится в кетоформе и енольной форме.
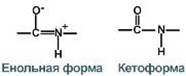
4. Способность к образованию водородных связей.
Атомы кислорода и водорода, входящие в пептидную группу, обладают способностью образовывать водородные связи с атомами кислорода и водорода других пептидных групп.
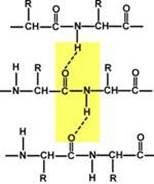
5. Пептидная связь имеет частично характер двойной связи.
Длина пептидной связи меньше, чем одинарной связи, она является жесткой структурой, и вращение вокруг нее затруднено. Но так как, кроме пептидной, в белке есть и другие связи, цепочка аминокислот способна вращаться вокруг основной оси, что придает белкам различную конформацию (пространственное расположение атомов).
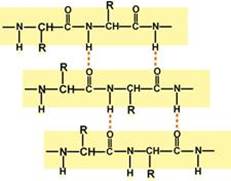
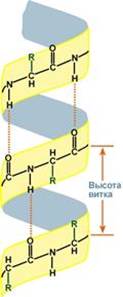
Вторичная структура белка – это способ укладки полипептидной цепи в более компактную структуру, при которой происходит взаимодействие пептидных групп с образованием между ними водородных связей.
Выделяют два возможных варианта вторичной структуры: в виде "каната" – α-спираль (α-структура), и в виде "гармошки" – β-складчатый слой (β-структура). В одном белке, как правило, одновременно присутствуют обе структуры, но в разном долевом соотношении. В глобулярных белках преобладает α-спираль, в фибриллярных – β-структура.
Вторичная структура образуется только при участии водородных связей между пептидными группами: атом кислорода одной группы реагирует с атомом водорода второй, одновременно кислород второй пептидной группы связывается с водородом третьей и т.д.
---
 2020-07-12
2020-07-12 662
662








