Состояние некоторой массы газа m определяется тремя термодинамическими параметрами: P, V, T. Здесь P -давление, V – объем, Т – температура.
Закон, выражающий зависимость между этими параметрами, называется уравнением состояния газа: f (P, V, T) = 0.
2 Дополнительные термодинамические параметры:
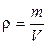 – плотность вещества;
– плотность вещества;
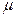 – молярная масса (масса одного моля);
– молярная масса (масса одного моля);
 – число молей;
– число молей;
 – концентрация молекул, где N число всех молекул в объеме V;
– концентрация молекул, где N число всех молекул в объеме V;
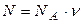 , где
, где 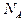 – число Авогадро (число молекул в 1 моле);
– число Авогадро (число молекул в 1 моле);
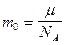 – масса одной молекулы любого вещества.
– масса одной молекулы любого вещества.
Термодинамические процессы
Изотермический процесс. Закон Бойля-Мариотта:
При T = const; m = const; PV = const.
Для 2-х состояний P 1 V 1 = P 2 V 2.
Изобарический процесс. Закон Гей-Люссака:
При P = const; m = const; V = V0 (1 +  t);
t); 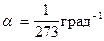 .
.
Для 2-х состояний  .
.
Изохорический процесс. Закон Шарля:
При V = const; m = const; P = P0 (1 +  t).
t).
Для 2-х состояний  .
.
Уравнение состояния идеального газа
Для данной массы газа (закон Клапейрона)
 .
.
Для 2-х состояний
 .
.
Для любой массы газа (уравнение Клапейрона - Менделеева)
 , или
, или  ,
,
где N – число молекул; R = 8,31 Дж/(моль∙К) - универсальная газовая постоянная; k = 1,38´10–23 Дж/К – постоянная Больцмана; R =kN а,откуда следует
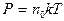 ,
,
где n 0 – концентрация молекул.
Закон Авогадро
Моли любых газов при одинаковой температуре и давлении занимают одинаковые объемы. При нормальных условиях (P 0= 1,01×105 Па, T =273,15К); 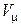 = 22,41×10–3 м3/моль.
= 22,41×10–3 м3/моль.
6 Давление смеси газов (закон Дальтона):
 ,
,
где Pi – парциальное давление i-го газа, n – число газов в смеси.
Масса 1 моля смеси газов:
 ,
,
где mi – масса i -го газа, входящего в смесь; 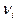 – число молей i -го газа, находящегося в смеси.
– число молей i -го газа, находящегося в смеси.
7 Основное уравнение кинетической теории газов:
 , или
, или 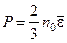 ,
,
где 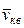 – среднеквадратичная скорость молекул;
– среднеквадратичная скорость молекул; 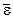 – средняя кинетическая энергия поступательного движения одной молекулы.
– средняя кинетическая энергия поступательного движения одной молекулы.
 2020-07-12
2020-07-12 90
90








