 – внутренняя энергия (функция состояния термодинамической системы) идеального газа, где i – число степеней свободы молекулы данного газа;
– внутренняя энергия (функция состояния термодинамической системы) идеального газа, где i – число степеней свободы молекулы данного газа;
Q – количество теплоты (мера процесса теплообмена, зависит от вида процесса); Q > 0 при получении энергии системой; Q < 0 при отдаче энергии системой;
 – теплоемкость (зависит от вида процесса);
– теплоемкость (зависит от вида процесса);
С – молярная теплоемкость, с – удельная теплоемкость;  ;
;
А – работа в термодинамике (зависит от вида процесса); А > 0 при совершении работы самой системой; A < 0 при совершении работы внешними силами над системой;
 - работа расширения идеального газа.
- работа расширения идеального газа.
Первое начало термодинамики
 – интегральная форма первого начала термодинамики, где
– интегральная форма первого начала термодинамики, где 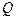 – количество теплоты, полученное системой;
– количество теплоты, полученное системой;  – приращение внутренней энергии системы;
– приращение внутренней энергии системы;  – работа, совершаемая системой;
– работа, совершаемая системой;
 – дифференциальная форма первого начала;
– дифференциальная форма первого начала;
 – общая формула для расчета количества теплоты.
– общая формула для расчета количества теплоты.
Применение первого начала термодинамики к идеальным газам
 – элементарная работа;
– элементарная работа;
 ,
,
где 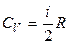 – молярная теплоемкость при постоянном объеме;
– молярная теплоемкость при постоянном объеме;
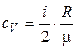 – удельная теплоемкость при постоянном объеме.
– удельная теплоемкость при постоянном объеме.
Адиабатический процесс (табл. 1)  ;
;
1)  , 2)
, 2)  , 3)
, 3)  ;
;
для двух состояний: 1) 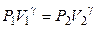 , 2)
, 2)  , 3)
, 3) 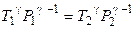 ,
,
где  – показатель адиабаты (коэффициент Пуассона);
– показатель адиабаты (коэффициент Пуассона);
 – молярная теплоемкость при постоянном давлении;
– молярная теплоемкость при постоянном давлении;
 – удельная теплоемкость при постоянном давлении,
– удельная теплоемкость при постоянном давлении,  .
.
Применение первого начала термодинамики к изопроцессам в идеальных газах
Таблица 1
| Изопроцесс | 1-е началотермодинамики | Теплоемкость | Количество теплоты | Совершаемая работа |
 (изотерм.)
(изотерм.)
| 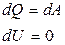
| 
| 
| 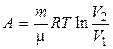
|
 (изохор.)
(изохор.)
| 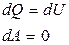
|  
| 
| 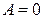
|
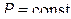 (изобарич.)
(изобарич.)
| 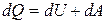
| 
| 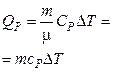
|
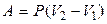
|
| Адиабати-ческий | 
| 
|

| 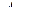 
|
 2020-07-12
2020-07-12 100
100








