Тема: Азотная кислота
Дата: 03.06.2020 (1 час)
Цель: изучитьстроение, физические и химические свойства азотной кислоты, основные лабораторные и промышленные способы ее получения.
Студенты должны знать: строение, физические и химические свойства азотной кислоты, основные способы ее получения в лаборатории и промышленности.
Студенты должны уметь: писать уравнения реакций с участием азотной кислоты в молекулярном, полном и сокращенном ионном видах; определять по внешним признакам, протекает ли данная химическая реакция до конца.
План.
1. Физические свойства.
2. Строение молекулы.
3. Способы получения.
4. Химические свойства.
Посмотреть видеоурок https://www.youtube.com/watch?v=et7P5Gv-t74
Опорный конспект
Физические свойства
Азотная кислота HNO 3 – это сильная одноосновная кислота-гидроксид. При обычных условиях бесцветная, дымящая на воздухе жидкость, температура плавления −41,59 °C, кипения +82,6 °C (при нормальном атмосферном давлении). Азотная кислота смешивается с водой во всех соотношениях. На свету частично разлагается.
Строение молекулы
Валентность азота в азотной кислоте равна IV, так как валентность V у азота отсутствует. При этом степень окисления атома азота равна +5. Так происходит потому, что атом азота образует 3 обменные связи и одну донорно-акцепторную, является донором электронной пары.
Поэтому строение молекулы азотной кислоты можно описать резонансными структурами:


Обозначим дополнительные связи между азотом и кислородом пунктиром. Этот пунктир по сути обозначает делокализованные электроны. Получается формула:

Способы получения
В лаборатории азотную кислоту можно получить разными способами:
1. Азотная кислота образуется при действии концентрированной серной кислоты на твердые нитраты металлов. При этом менее летучая серная кислота вытесняет более летучую азотную.
Например, концентрированная серная кислота вытесняет азотную из кристаллического нитрата калия:
KNO 3 + H 2 SO 4(конц) → KHSO 4 + HNO 3
2. В промышленности азотную кислоту получают из аммиака. Процесс осуществляется стадийно.
1 стадия. Каталитическое окисление аммиака.
4NH 3 + 5O 2 → 4NO + 6H 2 O
2 стадия. Окисление оксида азота (II) до оксида азота (IV) кислородом воздуха.
2NO + O 2 → 2NO 2
3 стадия. Поглощение оксида азота (IV) водой в присутствии избытка кислорода.
4NO 2 + 2H 2 O + O 2 → 4HNO 3
Химические свойства
Азотная кислота – это сильная кислота. За счет азота со степенью окисления +5 азотная кислота проявляет сильные окислительные свойства.
1. Азотная кислота практически полностью диссоциирует в водном растворе.
HNO 3 → H + + NO 3–
2. Азотная кислота изменяет окраску индикаторов:
НNO3 + лакмус фиолетовый  красная окраска раствора,
красная окраска раствора,
НNO3 + метиловый оранжевый  красная окраска раствора.
красная окраска раствора.
3. Взаимодействие азотной кислоты с металлами, стоящими в ряду активности после водорода:
Сu + 4НNO3 = Сu(NO3)2 + 2Н2О + 2NO2 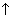 .
.
4. Взаимодействие азотной кислоты с основными оксидами:
СuО + 2НNO3 = Сu(NO3)2 + 2Н2О,
СuО + 2Н+ + 2NO3– = Сu2+ + 2NO3– + 2Н2О
(полное ионное уравнение),
СuО + 2Н+ = Сu2+ + 2Н2О
(сокращенное ионное уравнение).
5. Взаимодействие азотной кислоты с основаниями.
Непосредственно перед опытом получают гидроксид железа(III) по уравнению реакции:
FeCl3 + 3КОН = 3КСl + Fe(ОН)3  .
.
Затем действием азотной кислоты растворяют осадок Fe(OH)3:
Fe(ОН)3 + 3НNO3 = Fe(NO3)3 + 3Н2О,
Fe(ОН)3 + 3Н+ + 3NO3– = Fe3+ + 3NO3– + 3Н2О
(полное ионное уравнение),
Fe(ОН)3 + 3Н+ = Fe3+ + 3Н2О
(сокращенное ионное уравнение).
6. Взаимодействие азотной кислоты с солями, образованными более слабыми и летучими кислотами:
СаСО3 + 2НNO3 = Са(NO3)2 + 2Н2О + СО2 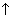 ,
,
СаСО3 + 2Н+ + 2NO3– = Са2+ + 2NO3– + 2Н2О + СО2 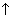
(полное ионное уравнение),
СаСО3 + 2Н+ = Са2+ + 2Н2О + СО2 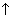
(сокращенное ионное уравнение).
Вопросы для самоконтроля
1. Какое агрегатное состояние имеет азотная кислота?
2. Чему равна валентность азота в молекуле азотной кислоты?
2. Чему равна степень окисления азота в молекуле азотной кислоты?
4. Как получают азотную кислоту в лаборатории?
5. Как получают азотную кислоту в промышленности?
6. Какие свойства проявляет азотная кислота?
7. С какими веществами взаимодействует азотная кислота?
 2020-06-29
2020-06-29 109
109







