Задачи, связанные с первым началом термодинамики, по сути являются задачами на закон сохранения энергии. Основными параметрами таких задач являются теплота, полученная/отданная системой, работа по расширению/сжатию газа и внутренняя энергия газа. Собственно эти фразы и определяют данные задачи. Подобные задачи основываются на изначальном внесении в систему (газ) энергии и вопрос о дальнейшем расширении и нагревании газа.
В общем случае для таких задач достаточно использовать:
§ первое начало термодинамики
§ определения работы идеального газа
§ определение внутренней энергии идеального газа
§ уравнение Менделеева-Клапейрона
§ иногда знание об изопроцессах
Примеры решения задач.
Задача 7.
При адиабатном расширении силой давления газа совершена работа 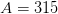 Дж. Определите приращение внутренней энергии газа. Как изменилась температура газа?
Дж. Определите приращение внутренней энергии газа. Как изменилась температура газа?
Дано:
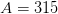 Дж
Дж
Найти:
 —?
—?
 —?
—?
Решение
Думаем: наша задача связана с энергетическими характеристиками газа. Для энергий используется логика первого начала термодинамики:
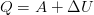 (1)
(1)
Фраза «адиабатный процесс» говорит об отсутствии теплообмена с окружающей средой, тогда:
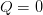 (2)
(2)
А зависимость от изменения температуры можно обнаружить в определении внутренней энергии:
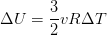 (3)
(3)
Решаем: уравнение (1) с учётом (2) примет следующий вид:
 (4)
(4)
Т.е. первый ответ задачи у нас уже есть.
Для анализа изменения температуры воспользуемся соотношением (4) и определением работы ( ). Т.к. газ расширяется, то
). Т.к. газ расширяется, то 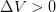 , тогда, исходя из (4) с учётом (3):
, тогда, исходя из (4) с учётом (3):
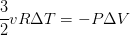 (5)
(5)
Таким образом, т.к. 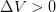 , то
, то 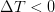 , т.е. в таком случае температура газа падает и газ охлаждается.
, т.е. в таком случае температура газа падает и газ охлаждается.
Считаем: исходя из (4) получим
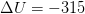 Дж
Дж
Ответ: 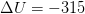 Дж, газ охлаждается.
Дж, газ охлаждается.
Решить задачу самостоятельно.
Задача 8.
Определите количество теплоты, сообщённое кислороду, если при изотермическом расширении работа, совершённая силой давления газа, 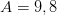 кДж.
кДж.
Дано:
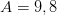 кДж
кДж
Найти:
 —?
—?
Решение
Думаем: вопрос о количестве теплоты при условии, что нам дана работа, совершённая газом, единственным образом может решиться исходя из первого начала термодинамики.
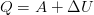 (1)
(1)
Фраза «изотермическое расширение» говорит о том, что температура тела в процессе не менялась, тогда, исходя из определения внутренней энергии газа (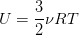 ), мы можем заключить, что внутренняя энергия также не меняется. Тогда:
), мы можем заключить, что внутренняя энергия также не меняется. Тогда:
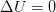 (2)
(2)
Решаем:
Задача 9.
При сообщении идеальному одноатомному газу количество теплоты 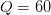 Дж его температура увеличилась при постоянном давлении на
Дж его температура увеличилась при постоянном давлении на 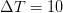 К. Определите количество вещества газа.
К. Определите количество вещества газа.
Дано:
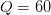 Дж
Дж
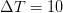 К
К
Найти:
 —?
—?
Решение
Думаем: теплоту, принятую телом, можно описать как через первое начало термодинамики, так и через процесс нагревания. Нам подходит первый вариант, т.к. именно в приведённом законе присутствует искомое химическое количество вещества ( ). Тогда:
). Тогда:
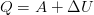 (1)
(1)
Иди в развёрнутом виде:
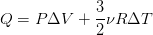 (2)
(2)
Неизвестные параметры работы газа, а именно давление ( ) и изменение объёма (
) и изменение объёма ( ) можно анализировать исходя из уравнения Менделеева-Клапейрона:
) можно анализировать исходя из уравнения Менделеева-Клапейрона:
 (3)
(3)
Решаем: проанализируем наш газ в обоих состояниях.
§ для начального состояния:
 (4)
(4)
§ для конечного состояния:
 (5)
(5)
Для описания параметров газа бы использовали знания из дано о том, что давление газа постоянно. Введённые нами параметры 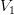 ,
,  ,
,  ,
, 
характеризуют объёмы и температуры газа в обоих состояниях. Нам они по сути не нужны, просто отнимем от (5) (4):
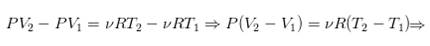
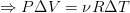 (6)
(6)
Тогда подставим (6) в (2):
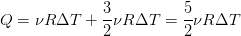 (7)
(7)
Выразим химическое количество вещества из (7):
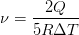 (8)
(8)
Считаем: помним о константах ( м
м  *кг*с
*кг*с  *К
*К  *Моль
*Моль  ).
).
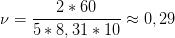 моль
моль
Ответ: 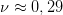 моль.
моль.
Фазовые переходы
Задачи на фазовые переходы содержат в себе намёки на фазовые превращения (кристаллизация/плавление, конденсация/испарение) и процессы нагревания/охлаждения тела в любом фазовом состоянии (твёрдое тело, жидкость, газ).
Чаще всего данные задачи связаны с уравнением теплового баланса.
Таким образом, решение подобного рода задач связано с поиском энергии, необходимой для рассматриваемых в задаче превращений и составления необходимого уравнения.
Кроме того, к задачам, относящимся к фазовым превращениям относят задачи на сгорание вещества.
Важно: для такого типа задач обычным является использование огромного количества табличных данных. Так, если нам дано конкретное вещество, с которым происходят фазовые превращения, то у нас есть набор характеризующих его констант:
§ удельная теплоёмкость (для нагревания/охлаждения)
§ удельная теплота кристаллизации/плавления
§ удельная теплота конденсации/испарения
Важно: процессы кристаллизации/плавления, конденсации/испарения и нагревания/охлаждения энергетически являются одинаковыми (т.е. энергия, необходимая для перевода вещества из одного состояния в другое равна по модулю энергии обратного перехода).
 2020-06-29
2020-06-29 111
111








