Количество независимых переменных, которыми определяется состояние системы, называют числом степеней свободы.
В классической статистической физике выводится закон Больцмана о равномерном распределении энергии по степеням свободы молекул: для статистической системы, находящейся в состоянии термодинамического равновесия, на каждую поступательную и вращательную степени свободы приходится в среднем кинетическая энергия, равная kT/ 2, а на каждую колебательную степень свободы — в среднем энергия, равная kT.
Согласно закону равномерного распределения энергии по степеням свободы на каждую степень свободы в среднем приходится одинаковая кинетическая энергия равная:
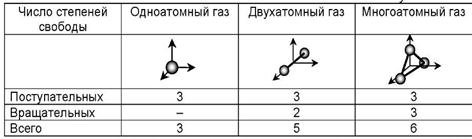
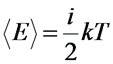 Число степеней свободы i зависит от строения молекул
Число степеней свободы i зависит от строения молекул
где i — сумма числа поступательных, числа вращательных в удвоенного числа колебательных степеней свободы молекулы:
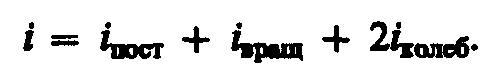
В таком случае можно сказать, что средняя энергия молекулы ⟨ε⟩ равна:
где сумма числа поступательных, вращательных и удвоенного количества колебательных степеней свободы,
k -- постоянная Больцмана (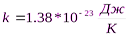 )
)
T - термодинамическая температура.
Возникновение коэффициента 2 при подсчёте энергии колебаний объясняется просто: При колебаниях частица имеет как кинетическую, так и потенциальную энергии. Если колебания гармонические, то эти энергии в среднем равны друг другу.
Так как в идеальном газе взаимная потенциальная энергия молекул равна нулю (молекулы между собой не взаимодействуют), то внутренняя энергия, отнесенная к одному молю газа, будет равна сумме кинетических энергий Na молекул:
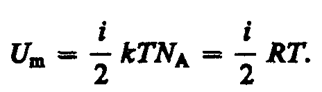
Внутренняя энергия для произвольной массы т газа:
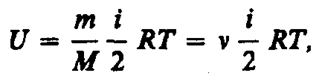
М – молярная масса, n - количество вещества
 2020-06-29
2020-06-29 1755
1755
