Количество теплоты Q, необходимое для нагревания 1 кг вещества на 1 К называют удельной теплоемкостью вещества c.
 | ||||
| Молярная теплоемкость C: | ||||
| C = M • c | ||||
Все количество теплоты, полученное телом, идет на изменение его внутренней энергии. В отличие от жидкостей и твердых тел, газ в процессе теплопередачи может сильно изменять свой объем и совершать работу. Поэтому теплоемкость газообразного вещества зависит от характера термодинамического процесса. Обычно рассматриваются два значения теплоемкости газов:
CV – молярная теплоемкость в изохорном процессе (V = const) и
Cp – молярная теплоемкость в изобарном процессе (p = const).
В процессе при V= const A = 0. Из 1 закона термодинамики для 1 моля газа:
|
Для процесса при p=const 1 закон термодинамики:
|
 , где Δ V – изменение объема 1 моля идеального газа при изменении его температуры на Δ T.
, где Δ V – изменение объема 1 моля идеального газа при изменении его температуры на Δ T.
Соотношение, выражающее связь между молярными теплоемкостями Cp и CV, имеет вид (формула Майера):
| Cp = CV + R. |
Два возможных процесса нагревания газа на Δ T = T 2 – T 1. При p = const газ совершает работу A = p 1(V 2 – V 1). Поэтому Cp > CV 
Отношение теплоемкостей в процессах с постоянным давлением и постоянным объемом:
|
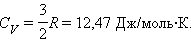 , при p=const
, при p=const
Если система молекул находится в тепловом равновесии при температуре T, то средняя кинетическая энергия равномерно распределена между всеми степенями свободы и для каждой степени свободы молекулы она равна 
Из этой теоремы следует, что молярные теплоемкости газа Cp и CV и их отношение γ могут быть записаны в виде
|
где i – число степеней свободы газа.
Для газа, состоящего из одноатомных молекул (i = 3)
|
Для газа, состоящего из двухатомных молекул (i = 5)
|
Для газа, состоящего из многоатомных молекул (i = 6)
|
 2020-06-29
2020-06-29 22380
22380













