Постулаты Бора
Первый постулат Бора: из бесконечного множества электронных орбит, возможных с точки зрения классической механики, осуществляются в действительности только некоторые дискретные орбиты, удовлетворяющие определенным квантовым состояниям, каждому из которых соответствует определенная энергия En. Электрон, находящийся на одной из этих орбит, не смотря на то, что он движется ускоренно, не излучает электромагнитных волн.
Второй постулат Бора: излучение испускается или поглощается в виде светового кванта энергии hn при переходе электрона из одного стационарного состояния в другое. Энергия кванта равна разности энергий тех стационарных состояний, между которыми совершается квантовый скачек электрона:
Если принять энергию электрона, удаленного от ядра на бесконечность, равную 0, то все En < 0. Величина E=E∞-E1=|E1| называется энергией ионизации. Состояние с энергией E1 называется
 основным состоянием атома.
основным состоянием атома.
Модель атома по Бору
Бор ввёл допущение, суть которого заключается в том, что электроны в атоме могут двигаться только по определённым (стационарным) орбитам, находясь на которых они не излучают энергию, а излучение или поглощение происходит только в момент перехода с одной орбиты на другую. Причём, стационарными являются лишь те орбиты, при движении по которым момент количества движения электрона равен целому числу постоянных Планка
Используя это допущение и законы классической механики, а именно равенство силы притяжения электрона со стороны ядра и центробежной силы, действующей на вращающийся электрон, он получил следующие значения для радиуса стационарной орбиты {\displaystyle R_{n}}R и энергии {\displaystyle E_{n}}E находящегося на этой орбите электрона:


Волны де Бройля
Волны де Бройля – волны, связанные с любой движущейся материальной частицей. Любая движущаяся частица (например, электрон) ведёт себя не только как локализованный в пространстве перемещающийся объект - корпускула, но и как волна, причём длина этой волны даётся формулой λ = h/р, где h = 6.6·10-34 Дж.сек – постоянная Планка, а р – импульс частицы. Если частица имеет массу m и скорость v << с (с – скорость света), то импульс частицы р = mv и дебройлевская длина волны связаны соотношением λ = h/mv.
Волновые свойства макроскопических объектов не проявляются из-за малых длин волн. Так для тела массой 200 г, движущегося со скоростью 3 м/сек, длина волны ≈10-31 см, что лежит далеко за пределами наблюдательных возможностей. Однако для микрочастиц длины волн лежат в доступной наблюдению области. Например, для электрона, ускоренного разностью потенциалов 100 вольт, длина волны ≈10-8 см, что соответствует размеру атома.
Для расчёта длины волны де Бройля частицы массы m, имеющей кинетическую энергию E, удобно использовать соотношение

где E0 = mc2 − энергия покоя частицы массы m,
λкомптон = h/mc − комптоновская длина волны частицы,
λкомптон (электрон) = 2.4·10-12 м = 0.024 Å,
λкомптон (протон) = 1.32·10-15 м = 1.32 фм.
Длина волны де Бройля фотона с энергией Е определяется из соотношения
λ(фм) = h/p = hc/E = 2π·197 МэВ·фм /E(МэВ).
Существование волн де Бройля доказано многочисленными экспериментами, в которых частицы ведут себя как волны. Так при рассеянии пучка электронов с энергией 100 эВ на упорядоченной системе атомов кристалла, играющего роль дифракционной решётки, наблюдается отчётливая дифракционная картина. Существование волн де Бройля лежит в основе работы электронного микроскопа, разрешающая способность которого намного порядков выше, чем у любого оптического микроскопа, что позволяет наблюдать молекулы и атомы, а также в основе методов исследования таких сверхмалых объектов, как атомные ядра и элементарные частицы, бомбардировкой их частицами высоких энергий. Метод дифракции частиц в настоящее время широко используется при изучении строения и свойств вещества.
93. Соотношение неопределенностей Гейзенберга
Корпускулярно-волновая двойственность свойств частиц, изучаемых в квантовой механике, приводит к тому, что в ряде случаев оказывается невозможным, в классическом смысле, одновременно характеризовать частицу ее положением в пространстве (координатами) и скоростью (или импульсом). Так, например, электрон (и любая другая микрочастица) не может иметь одновременно точных значений координаты x и компоненты импульса  . Неопределенности значений x и
. Неопределенности значений x и  удовлетворяют соотношению:
удовлетворяют соотношению:

Из следует, что чем меньше неопределенность одной величины (x или 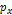 ), тем больше неопределенность другой. Возможно, такое состояние, в котором одна их переменных имеет точное значение (
), тем больше неопределенность другой. Возможно, такое состояние, в котором одна их переменных имеет точное значение ( ), другая переменная при этом оказывается совершенно неопределенной (
), другая переменная при этом оказывается совершенно неопределенной ( – ее неопределенность равна бесконечности), и наоборот. Таким образом, для микрочастицы не существует состояний, в которых ее координаты и импульс имели бы одновременно точные значения.
– ее неопределенность равна бесконечности), и наоборот. Таким образом, для микрочастицы не существует состояний, в которых ее координаты и импульс имели бы одновременно точные значения.
Соотношение канонически сопряженных величин называется соотношением неопределенностей.
Утверждение о том, что произведение неопределенностей значений двух сопряженных переменных не может быть по порядку меньше постоянной Планка h, называется соотношением неопределенностей Гейзенберга.
Соотношение неопределенностей указывает, в какой мере возможно пользоваться понятиями классической механики применительно к микрочастицам, в частности с какой степенью точности можно говорить о траекториях микрочастиц. Движение по траектории характеризуется вполне определенными значениями координат и скорости в каждый момент времени.

Из этого соотношения следует, что чем больше масса частицы, тем меньше неопределенности ее координаты и скорости, следовательно тем с большей точностью можно применять к этой частице понятие траектории.
94. Пси-функция. Временное и стационарное уравнения Шредингера
Физический смысл ψ(x,y,z,t) заключается в том, что квадрат ее модуля определяет вероятность обнаружить частицу в пределах объема dV: dP = A│ψ│ 2 dV, где А – некоторый коэффициент пропорциональности, который находится из условия

(звездочка означает комплексное сопряжение). Это позволяет переопределить пси-функцию таким образом, чтобы было выполнено условие нормировки для самой волновой функции:

Из смысла пси-функции следует, что квантовая механика имеет статистический характер. С помощью волновой функции можно только предсказать, с какой вероятностью частица может быть обнаружена в данном месте пространства.
Сама волновая функция является решением дифференциального уравнения, которое впервые получил Шрёдингер в 1926 г.
Само уравнение выглядит следующим образом:

где  - оператор Лапласа; m – масса частицы; U (x, y, z, t) - функция, градиент которой, взятый со знаком минус, определяет силу, действующую на частицу. Если функция U не зависит от времени, то она имеет смысл потенциальной энергии.
- оператор Лапласа; m – масса частицы; U (x, y, z, t) - функция, градиент которой, взятый со знаком минус, определяет силу, действующую на частицу. Если функция U не зависит от времени, то она имеет смысл потенциальной энергии.
сли силовое поле, в котором движется частица, стационарно, то U не зависит явно от времени, и в этом случае решение уравнения Шрёдингира можно представить в виде произведения двух множителей, один из которых зависит только от времени, другой – от координат:

где Е – полная энергия частицы (в случае стационарных полей остается постоянной). После подстановки этого выражения в исходное уравнение Шрёдингира и сокращения на экспоненту  получаем уравнение Шрёдингира для стационарных состояний:
получаем уравнение Шрёдингира для стационарных состояний:

Для того, чтобы решение уравнения Шрёдингера имело смысл, необходимо, чтобы волновая функция ψ удовлетворяла следующим условиям:
1). Однозначность: ψ должна быть однозначной функцией координат и времени, в противном случае мы получим, что для одной и той же точки с радиусом-вектором r имеются две и более вероятности, что лишено всякого физического смысла.
2) Конечность:Чтобы вероятность была конечной (с учетом нормировки) необходимо, чтобы ψ была всюду конечной и вместе со своими первыми производными обращалась в 0 на бесконечности.
3). Непрерывность:состояние квантовой системы в пространстве и времени должно меняться непрерывно (в отличие от самих физических величин). А это значит, что ψ и ее производные должны быть непрерывными
 2020-06-29
2020-06-29 180
180








