Тема 8. Химические свойства водорода, щелочных и щелочноземельных металлов
Водород
Водород – самый распространённый элемент во Вселенной (около 88,6 % атомных), содержание водорода в земной коре составляет 16 % всех атомов, но по массе это составляет лишь около 1 %. Водород входит в состав практически всех органических веществ.
Получение газа водорода
В лаборатории.
1. Действие кислот на металлы, например:
Mg + H2SO4 (разб.) = MgSO4 + H2
2. Действие растворов щелочей на цинк или алюминий, например:
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
3. Взаимодействие гидридов щелочных и щелочноземельных металлов (ионных гидридов) с водой:
NaH + H2O = NaOH + H2
CaH2 + 2H2O = Ca(OH)2 + 2H2
В промышленности.
1. Электролиз воды:
2H2O  2H2 + O2
2H2 + O2
катод анод
2. Паровая конверсия природного газа:
CH4 + H2O  СО + 3H2
СО + 3H2
3. Газификация угля (старейший промышленный способ):
C + H2O  СО + H2
СО + H2
Химические свойства водорода
1. Реагирует со многими неметаллами – фтором, кислородом, азотом, хлором, серой, углеродом:
H2 + F2 = 2HF
2H2 + O2  2H2O
2H2O
3H2 + N2  2NH3
2NH3
H2 + Cl2  2HCl
2HCl
H2 + S  H2S
H2S
2H2 + C  CH4
CH4
! Следует запомнить, что водород не реагирует с кремнием, фосфором, мышьяком
2. Водород реагирует с щелочными и щелочноземельными металлами с образованием ионных гидридов, например:
2К + H2  2KH
2KH
3. Водород при нагревании восстанавливает многие металлы (кроме активных) из их оксидов, например:
CuO + H2  Cu + H2O
Cu + H2O
WO3 + 3H2  W + 3H2O
W + 3H2O
FeFe2O4 + 4H2  3Fe + 4H2O
3Fe + 4H2O
4. Водород, как восстановитель, при нагревании реагирует со многими сложными веществами, например:
4H2 + Na2SO4  Na2S + 4H2O
Na2S + 4H2O
4H2 + СO2  CH4 + 2H2O
CH4 + 2H2O
5. Водород реагирует со многими органическими веществами (реакции гидрогенизации или гидрирования), например:
C2H4 + H2  C2H6
C2H6
R–COH  R–CH2–OH
R–CH2–OH
Аналитическое определение водорода
1. Водород сгорает с характерным хлопком.
2. При нагревании восстанавливает черный оксид меди до красной меди.
Применение водорода
1. Производство аммиака.
2. Нефтепереработка и химическая промышленность
3. Металлургия.
4. Стекольная промышленность.
Большое промышленное значение имеют смеси, содержащие газ водород:
– гремучий газ: смесь H2 и O2 или H2 и воздуха;
– синтез-газ: смесь СО и H2.
Щелочные металлы
Это металлы 1 группы главной подгруппы (Приложение А). Натрий и калий принадлежат к наиболее распространенным на земле элементам.
Получение щелочных металлов
1. Металлотермия. Щелочные металлы могут быть получены из соответствующего хлорида или гидроксида сильным восстановителем при нагревании под вакуумом до 600—900 °C, например:
2RbCl + Ca 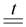 2Rb + CaCl2
2Rb + CaCl2
KOH + Na 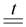 K + NaOH
K + NaOH
Реакция возможна из-за образования паров щелочных металлов (все они имеют низкие температуры плавления и кипения).
2. Электролиз расплавов хлоридов или гидроксидов:
2NaCl (расплав)  2Na + Cl2
2Na + Cl2
катод анод
4KOH (расплав)  4K + 2H2O + О2
4K + 2H2O + О2
катод анод
 2020-06-29
2020-06-29 160
160







