Тема 6. Строение вещества
1. Основные виды химической связи.
2. Пространственное строение молекул.
3. Строение кристаллов.
4. Причины многообразия веществ.
Основные виды химической связи.
Химическая связь - явление взаимодействия атомов, обусловленное перекрыванием электронных облаков связывающихся частиц, которое сопровождается уменьшением полной энергии системы.
Виды химической связи:
1. Ковалентная связь – связь атомов за счет обществления электронной пары с антипараллельными спинами. Ковалентная неполярная связь возникает между неметаллами, разность электроотрицательности между которыми невелика. Соответственно ковалентная полярная связь возникает между элементами с большой электроотрицательностью (пример: HCl Э.О.(H)=2,2; Э.О.(Cl)=3,1; D Э.О.=0,9).
2. Ионная связь – это связь между ионами, т.е связь между атомами. Обусловлена электростатическим взаимодействием противоположно заряженных ионов. Рассматривается как отдельный случай ковалентной полярной связи. Для ионной связи D Э.О.>2 (пример: NaCl Э.О.(Na)=0,9; Э.О.(Cl)=3,1; D Э.О.=2,2).
3. Водородная связь – связь, обусловленная положительно поляризованным водородом в молекуле и электроотрицательным атомом другой или той же молекулы.
4. Металлическая связь – связь, обусловленная электростатическим взаимодействием между обобществленными делокализованными валентными электронами и положительно заряженными катионами в узлах кристаллической решетки.
Основные характеристики ковалентной связи:
1. Энергия химической связи (Exc) – определяет прочность связи. Данная энергия необходима для превращения одного моля газообразного (молекулярного) вещества в отдельные газообразные атомы. Энергия ковалентной связи имеет порядок 10-1000 кДж/моль.
2. Длина химической связи (Lxc) – расстояние между ядрами химически связанных атомов. Чем короче длина химической связи, тем связь прочнее. Длина химической связи имеет порядок 0,1-0,3 нм.
3. Полярность химической связи – неравномерное распределение электронной плотности между атомами в молекуле из-за разной электроотрицательности. В неполярных молекулах центры тяжести положительных и отрицательных зарядов совпадают. Полярные молекулы являются диполями.
4. Поляризуемость – способность электронной плотности становится полярной в результате действия на молекулу внешнего электрического поля – в частности поля других молекул, вступающих в реакцию.
5. Направленность – определенное направление химической связи, которое возникает в результате перекрывания электронных облаков. Направленность определяется строением молекулы.
Механизм возникновения ковалентной связи:
1. Обменный – механизм возникновения ковалентной связи путем обобществления неспаренных электронов других атомов.
2. Донорно-акцепторный – механизм возникновения ковалентной связи, при котором один атом, имеющий неподеленную электронную пару (донор), предоставляет ее свободную орбиталь другого атома (акцептор).
К межмолекулярным взаимодействиям относятся: ориентационные – диполь-диполь; индукционные – диполь-не диполь и дисперсионные – за счет микродиполей.
Пространственное строение молекул.
Образование ковалентных связей в неорганических соединениях сходно по механизму с таковым у органических веществ. Для образования связи необходимо наличие неподеленных электронных пар у двух атомов, которые образуют общее электронное облако. Перекрывание орбиталей при образовании ковалентной связи происходит по одной линии ядер атомов. Если атом образует две и более связи, то расстояние между ними характеризуется величиной валентного угла. Если рассматривать молекулу воды, которая образована одним атомом кислорода и двумя атомами водорода, валентный угол в идеале должен был бы составить 90 градусов. Однако экспериментальные исследования доказали, что эта величина составляет 104,5 градусов. Пространственное строение молекул отличается от теоретически предсказанного из-за наличия сил взаимодействия между атомами водорода. Они отталкиваются друг от друга, тем самым увеличивая валентный угол между ними.
Sp-гибридизация Гибридизация – это теория образования одинаковых гибридных орбиталей молекулы. Происходит это явление из-за наличия у центрального атома неподеленных электронных пар на разных энергетических уровнях. Для примера рассмотрим образование ковалентных связей молекулы BeCl2. У Бериллия неподеленные электронные пары находятся на s и p уровнях, что в теории должно послужить причиной образования неровной угловой молекулы. Однако на практике они линейные, а валентный угол составляет 180 градусов. Sp-гибридизация используется при формировании двух ковалентных связей. Однако существуют и другие виды образования гибридных орбиталей.
Sp2-гибридизация Этот тип гибридизации отвечает за пространственное строение молекул с тремя ковалентными связями. Примером является молекула BCl3. Центральный атом бария имеет три неподеленные электронные пары: две на p-уровне и одну на s-уровне. Три ковалентные связи образуют молекулу, которая располагается в одной плоскости, а ее валентный угол составляет 120 градусов.
Sp3-гибридизация Еще один вариант формирования гибридных орбиталей, когда центральный атом имеет 4 неподеленные электронные пары: 3 на p-уровне и 1 на s-уровне. Пример такого вещества – метан. Пространственное строение молекул метана представляет собой тетраэрд, валентный угол в котором составляет 109,5 градусов. Изменение величины угла характеризуется взаимодействием атомов водорода между собой.
Смешение одной s -орбитали и трех p -орбиталей дает четыре sp3 -гибридные орбитали, вытянутые по углам тетраэдра с атомом С в центре. Углерод в метане находится в состоянии sp3-гибридизации. Рис. 1.

Рис. 1. Строение метана
Строение аммиака
Таким же образом гибридизуются четыре орбитали атома азота в молекуле аммиака NH3: У атома азота 5 электронов на внешнем уровне. Поэтому на одной sp3-орбитали расположена неподеленная пара электронов, а на остальных трех – электронные пары связей N-H. Все четыре электронные пары располагаются по углам искаженного тетраэдра (электронное облако неподеленной пары больше, чем связывающей). Рис. 2
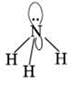
 Рис. 2. Строение аммиака
Рис. 2. Строение аммиака
Строение воды
У атома кислорода 6 электронов на внешнем уровне. Поэтому на двух sp3-орбиталях расположены неподеленные пары электронов, а на остальных двух – электронные пары связей О-H. Молекула имеет угловое строение. 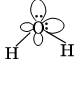 Рис. 3. Строение воды
Рис. 3. Строение воды
При таком анализе строения молекул важно не путать геометрию расположения в пространстве электронных пар и геометрию химических связей. Мы видим, что в аммиаке и воде не все электронные пары участвуют в образовании химических связей.
Геометрия молекул или химических связей рассматривает именно расположение атомов в пространстве, не описывая расположение неподеленных электронных пар. Электронные облака гибридных орбиталей стараются как можно дальше оттолкнуться друг от друга. Если облака четыре– то они разойдутся по углам тетраэдра, три – разместятся в плоскости под углом 120°.
 2020-06-29
2020-06-29 2181
2181