Среди сложных биополимеров по функциональному значению и в количественном соотношении главная роль принадлежит белкам. В животной клетке они составляют 40—50% ее сухой массы, в растительной — 20-— 35%. Огромное разнообразие живых существ в значительной степени определяется различиями в составе их белков. Только в организме человека их насчитывается более 5 миллионов типов. Причина такого многообразия белков объясняется спецификой их строения. Белки представляют собой полимеры, мономерами которых являются аминокислоты. Известно 20 видов аминокислот, входящих в состав молекул белков Их называют основными, с тем чтобы отличить от других аминокислот также присутствующих в организмах, но не входящих в состав белковых молекул. Все эти аминокислоты в составе своих молекул имеют одинаковую структуру атомов
R
I
Н-С-СООН, где СООН — карбоксильная группа, a nh2 —
I
nh2
аминогруппа.
Четвертая валентная связь углерода занята так называемым радикалом (R). Радикалы различных видов аминокислот отличаются друг от друга по химической структуре, электрическим зарядам, а также по способности растворяться в воде. Аминокислоты являются амфотерными соединениями, т. е. одна и та же аминокислота может выступать как в роли кислоты, так и в роли щелочи. Кислотные свойства ей придает карбоксильная группа (СООН), а щелочные — аминогруппа (NH2). Благодаря амфотерности аминокислоты могут взаимодействовать друг с другом, причем одна из них выступает в роли кислоты, а другая — в роли щелочи; карбоксильная группа одной аминокислоты взаимодействует с аминогруппой другой). Соединение аминокислот в почку белка осуществляется за счет прочных ковалентных связей. Этот процесс можно записать при помощи такого уравнения:
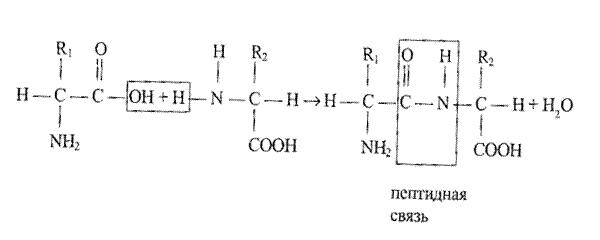
Образовавшееся соединение аминокислот называется пептидом, а ковалентная связь между ними — пептидной связью. Все белки представляют собой полипептиды, т. е. цепи, состоящие из многих десятков и даже сотен аминокислотных звеньев. Из 20 видов аминокислот можно построить огромное количество белков, точно так же как из 20 букв алфавита можно составить множество слов, смысл которых будет зависеть от того, из каких букв они составлены, в каком количестве взяты и в каком порядке установлены. Свойства же молекулы белка определяются составом аминокислот, числом аминокислотных звеньев, а также порядком их следования в цепи.
Последовательность аминокислотных остатков в молекуле белка определяет его первичную структуру (рис. 1-I). Если учесть, что размер одного аминокислотного звена равен 0,35—0,37 нм, то очевидно, что макромолекула белка, которая состоит из сотен аминокислотных остатков, должна была бы иметь в длину несколько десятков нанометров. В действительности же размеры белков гораздо меньше, потому что в пространстве полипептидная цепь полностью или частично закручена в спираль, которая представляет собой вторичную структуру белка (рис. 1-II). Аминокислотные радикалы остаются при этом снаружи спирали, а между NH-группами, находящимися на одном витке, и СО-группами, находящимися на соседнем витке спирали, образуются водородные связи. Они значительно слабее ковалентных, но, повторенные многократно, дают прочное сцепление. Полипептидная спираль, «прошитая» многочисленными водородными связями, представляет собой достаточно прочную структуру. Полипептидная спираль подвергается дальнейшей укладке — она сворачивается причудливо, но для каждого белка вполне определенно и постоянно в так называемую глобулу (шарик), которая и представляет собой третичную структуру молекулы белка (рис. 1-III).
Третичная структура белка поддерживается связями трех типов: ионными, водородными и дисульфидными, а также гидрофобными взаимодействиями. В количественном отношении наиболее важны гидрофобные взаимоотношения: в водной среде клетки гидрофобные радикалы, отталкиваются друг с другом. Таким образом, водная среда как бы принуждает белковую молекулу принять определенную упорядоченную структуру, которая становится биологически активной.
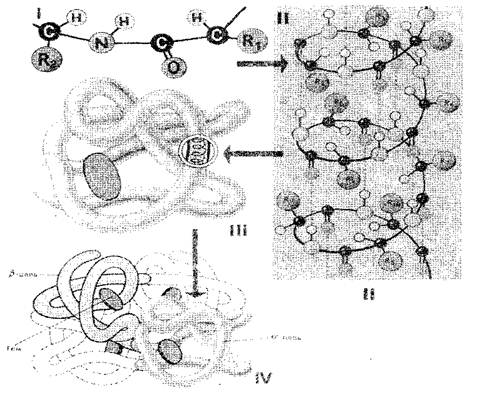
Рис. 1. Схема строения белковой клетки: I, II, III, IV — первичная, вторичная, третичная, четвертичная структуры
Белки, состоящие из одной полипептидной цепи, имеют только третичную структуру. Однако некоторые белки построены из нескольких полипептидных цепей. Для них введено понятие четвертичной структуры (рис. 1-IV), которая представляет собой единую функциональную единицу удерживаемую за счет как гидрофобных взаимодействий, так и водородных и ионных связей. Четвертичная структура характерна, например, для гемоглобина. Его молекула состоит из четырех отдельных полипептидных цепей. Некоторые вирусы, например, вирус мозаики табака, имеет белковую оболочку, состоящую из многих полипептидных цепей, упакованных высокоупорядоченным образом.
Под действием различных физико-химических факторов (действия концентрированных кислот и щелочей, тяжелых металлов, высокой температуры и т. п.) структура, а значит, и свойства белковых молекул могут изменяться. Процесс нарушения природной структуры белка или разворачивание полипептидной цепи без нарушения пептидных связей называется денатурацией белка (рис. 2). Как правило, денатурация носит необратимый характер, однако, на первых стадиях, при условии приостановки действия негативных факторов, белок может восстанавливать свою первоначальную структуру – этот процесс носит название ренатурации белка. Процесс разрушения первичной структуры белка всегда необратим, он называется деструкцией белка.
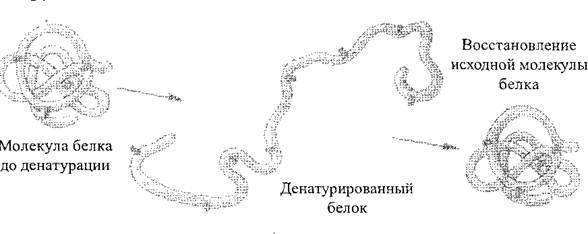
Рис. 2. Схема процесса денатурации белка
Физические и химические свойства белков очень разнообразны: существуют белки гидрофильные и гидрофобные, одни из них легко изменяют свою структуру в результате даже незначительного воздействия факторов внешней среды, другие оказываются стойкими по отношению к этим факторам. По физико-химическим свойствам белки делятся на простые (протеины) и сложные (протеиды).
Простые белки состоят исключительно из остатков аминокислот, сложные же включают в себя еще и соединения другой природы, такие как остатки фосфорной и нуклеиновых кислот, углеводов, липидов и др.
Биологические функции белков чрезвычайно разнообразны. Прежде всего они выполняют строительную функцию. Белки являются составной частью клеточных мембран, из них состоят такие немембранные органеллы клетки, как микротрубочки и микронити, составляющие скелет клетки (цитоскелет). Из белков, обладающих прочностью и эластичностью, состоят хрящи, сухожилия, связки. Из прочного и нерастворимого белка кератина построены ногти, перья. Помимо строительной, белки выполняют еще и защитную функцию, которая заключается, как в предотвращении повреждений клеток, органов и организма в целом, так и в защите организма от паразитов и чужеродных белков. В организме позвоночных животных образуются защитные белки — антитела. Это специализированные белки, которые вырабатываются лимфоцитами крови. Они способны «распознавать» и обезвреживать бактерии, вирусы, чужеродные для организма белки. Белок крови фибрин обуславливает ее свертывание, защищая организм от больших кровопотерь.
Регуляторная функция белков заключается в способности регулировать активность обмена веществ при помощи гормонов белковой природы, а также белков-ферментов. Белки выполняют и сигнальную функцию. Она заключается в способности отдельных сложных белков, входящих в состав клеточной мембраны, «распознавать» специфические химические соединения и определенным образом на них реагировать: связывать их, изменяя свою структуру, передавать сигналы о присутствии этих веществ в другие участки мембраны или внутрь клетки. Благодаря сигнальной функции белков, клетка может избирательно поглощать вещества из внешней среды.
Двигательная функция белков заключается в способности некоторых из них сокращаться, обеспечивая тем самым возможность клетки, ткани, организма в целом изменять свою форму, двигаться. Так, за счет таких белков как актин и миозин, входящих в состав мышечных клеток, мышечное волокно укорачивается; белок турбулин, из которого состоят микротрубочки и микронити, обеспечивает движение ресничек и жгутиков эукариотических клеток.
Некоторые белки могут откладываться клеткой про запас, выполняя тем самым запасающую функцию.
В эндосперме семян многих видов растений (пшеницы, кукурузы, риса) есть белки, которыми зародыш питается на первых этапах своего развития. Функцию этих белков можно определить как питательную.
Белки способны осуществлять транспорт некоторых веществ как внутри клетки, так и внутри организма. Например, белок крови человека и позвоночных животных гемоглобин транспортирует кислород от органов дыхания к клеткам, а углекислый газ — в обратном направлении.
Энергетическая функция белков состоит в том, что при их расщеплении в клетке освобождается энергия. Часть аминокислот, которые образуются при расщеплении, используется для биосинтеза новых белков, а остальные — расщепляются до конечных продуктов распада с освобождением энергии (при полном расщеплении 1 г белков в среднем освобождается 17,2 кДж энергии).
Одна из основных функций белка — ферментативная. Ферменты — это биологические катализаторы или ускорители химических реакций, проходящих в живом организме. Как известно, скорость химических реакций существенным образом зависит от концентрации веществ, а также температуры среды, в которой эти реакции протекают. Если учесть, что жизнь клетки (организма) — это совокупность огромного количества реакций синтеза и распада, которые составляют обмен веществ, то становится понятной огромная роль белков-ферментов в процессах жизнедеятельности организма на всех его уровнях. Только благодаря ферментам, при сравнительно низкой температуре организма и малой концентрации веществ в его клетках и тканях химические реакции протекают с достаточно большой скоростью (ферментативная реакция протекает в 100—1000 раз быстрее, нежели в среде без ферментов). Каталитическую активность белка-фермента обуславливает не вся молекула, а только ее небольшая часть, называемая активным центром. Пространственная структура активного центра как ключ к замку подходит по форме к пространственной структуре катализируемого вещества (субстрата), именно этим объясняется специфичность белков-ферментов (рис. 3).
При денатурации белковой молекулы нарушается структура активного центра, и фермент теряет свою каталитическую способность. Так, белок-фермент каталаза, обуславливающий реакцию расщепления пероксида водорода (Н2О2) до кислорода и воды утрачивает свою каталитическую активность после воздействия на него высокой температурой. Вот почему капля пероксида водорода, нанесенная на ломтик сырого картофеля, содержащего большое количество каталазы, «вскипает», а на вареном картофеле — остается без изменения.
Белки-ферменты, обуславливая прохождение химических реакций, сами при этом остаются без изменений, их иногда сравнивают с иглой, которая соединяя два куска ткани воедино, сама при этом остается без изменения.
Ферменты расположены определенным образом как в клетке, так и в организме в целом. В клетке ферменты часто связаны с ее мембранами или мембранами отдельных органелл (митохондрий, пластид и т. п.). Действие на организм лекарственных препаратов, гормонов, ядов состоит в том, что они могут стимулировать или, наоборот, угнетать тот или иной ферментативный процесс.
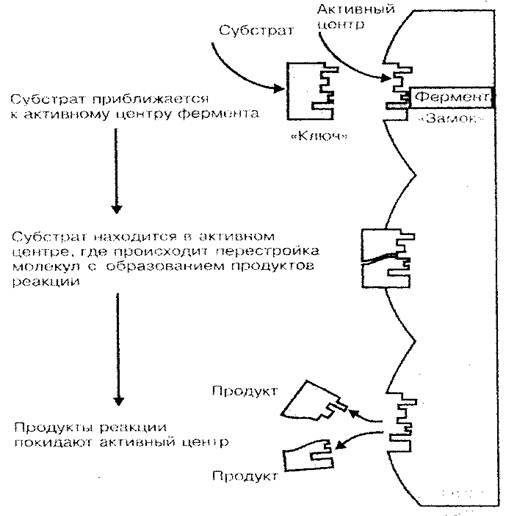
Рис. 3 Схема связывания фермента с субстратом
Организмы способны регулировать биосинтез ферментов. Это делает возможным поддержание относительного постоянства их химического состава, независимо от постоянно меняющихся условий среды.
Лабораторная работа № 1
 2014-02-24
2014-02-24 4567
4567
