Последовательные реакции – реакции, которые протекают через ряд стадий, в каждой из которых претерпевает превращение продукт, образовавшийся в предыдущей стадии:
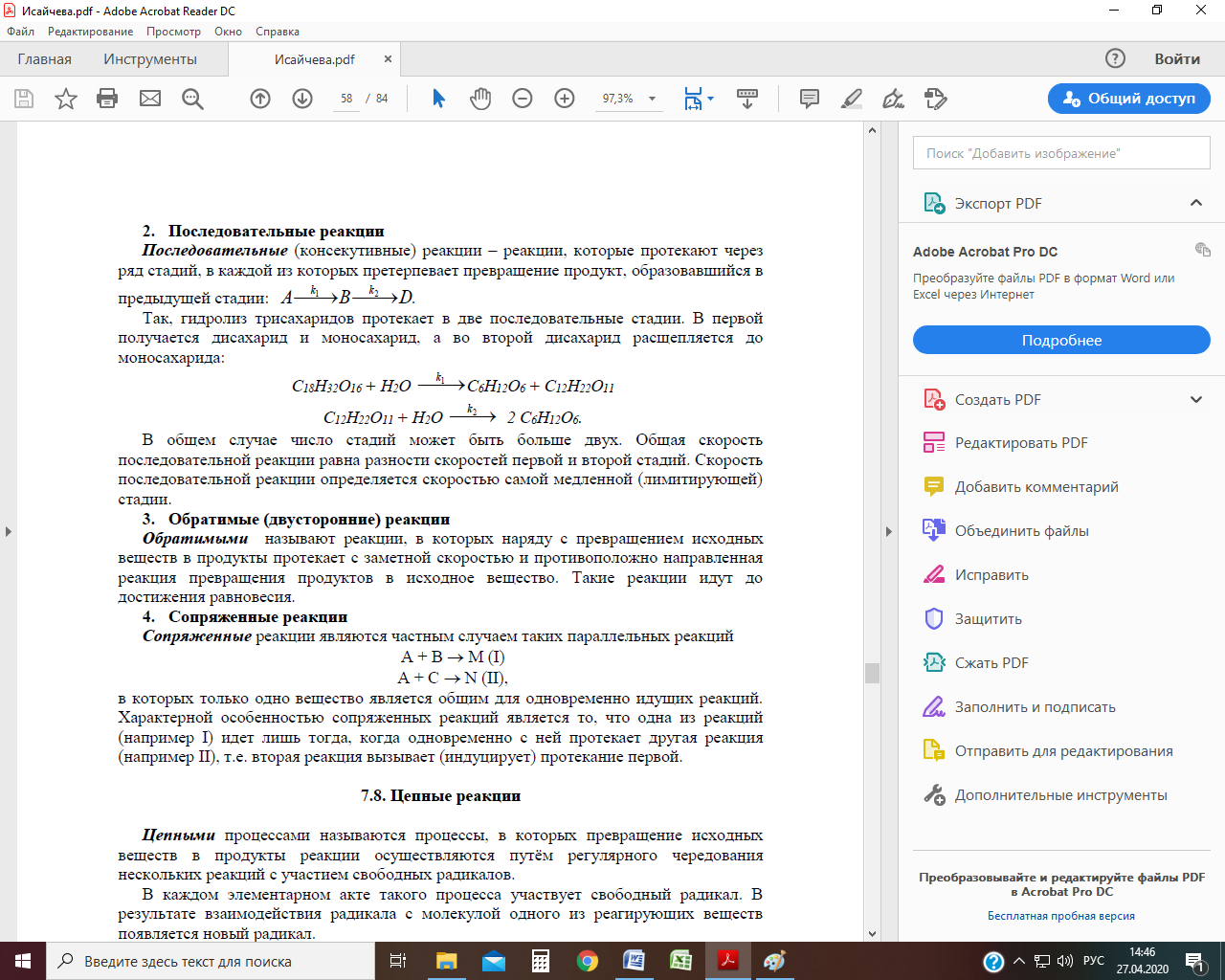
Согласно этой схеме вещество А превращается в В, из которого затем образуется D. Константа скорости первой реакции k 1, второй – k 2. Скорость исчезновения вещества А равна:
w 1 =k 1 С 1,
вещество В появляется со скоростью исчезновения А, которое одновременно превращается в D со скоростью:
w 2 = k 2 С 2 ,
соответственно, скорость изменения концентрации В составит:
w В = w 1 – w 2 = k 1 С 1 – k 2 С 2 .
Вещество D появляется со скоростью исчезновения В.
Общая скорость последовательной реакции равна разности скоростей первой и второй стадий. Скорость последовательной реакции определяется скоростью самой медленной (лимитирующей) стадии.
Так, гидролиз трисахаридов протекает в две последовательные стадии. В первой получается дисахарид и моносахарид, а во второй дисахарид расщепляется до моносахарида:

В общем случае число стадий может быть больше двух.
Зависимость концентраций веществ от времени в системе двух последовательных реакций первого порядка представлена на рис.
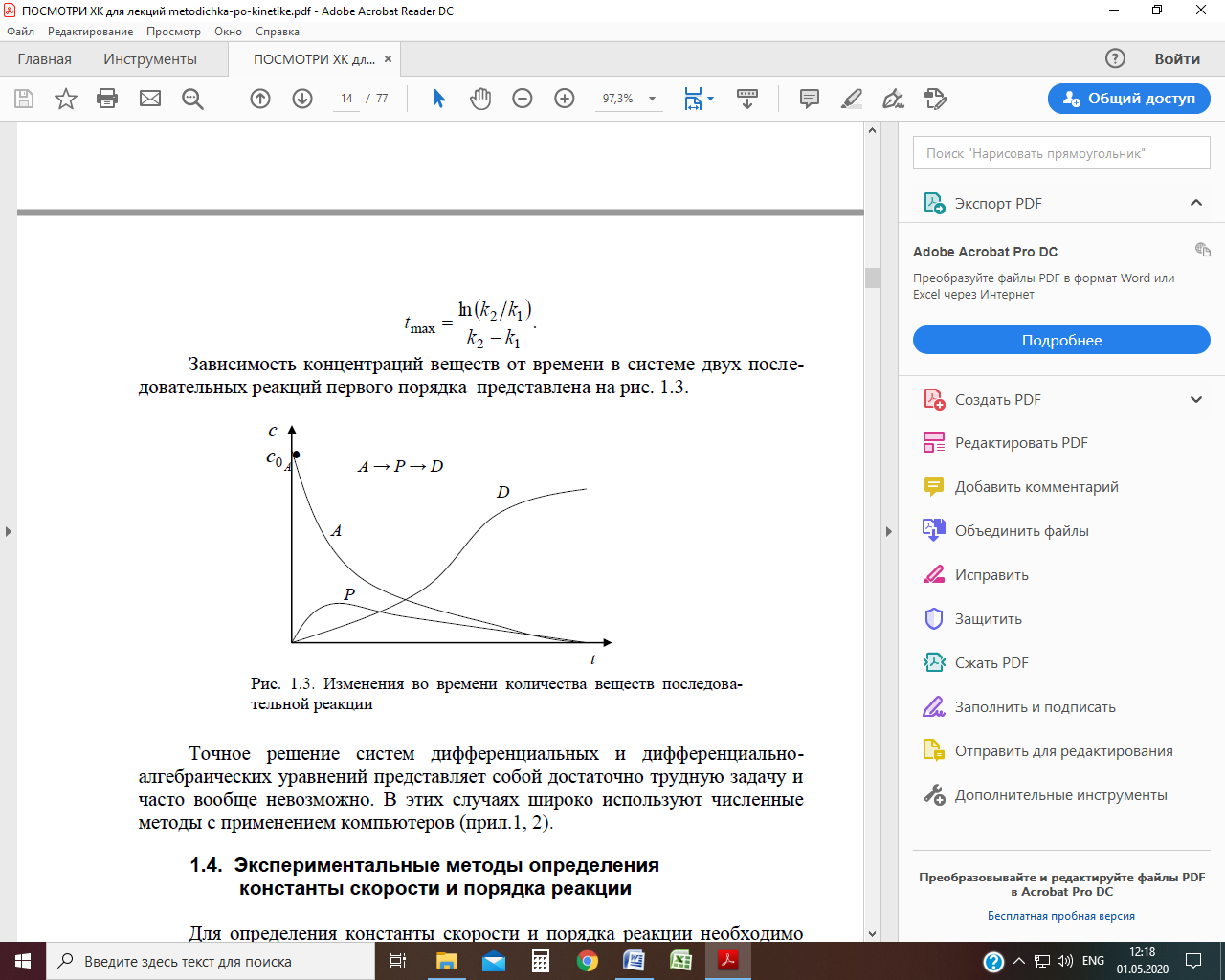
Рис. Изменения во времени количества веществ последовательной реакции
 2020-06-29
2020-06-29 138
138








