Идеальные газы подчиняются уравнению состояния Менделеева – Клапейрона
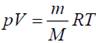
где p – давление газа; V – его объем; Т – термодинамическая температура; m – масса газа; М – молярная масса газа; R = 8,31441 Дж/(моль∙К) – универсальная газовая постоянная; отношение v = m/М определяет число молей вещества.
По закону Дальтона давление смеси газов равно сумме их парциальных давлений, т. е. тех давлений, которые имел бы каждый из газов в отдельности, если бы он при данной температуре один заполнял весь объем.
Основное уравнение молекулярно-кинетической теории для давления идеальных газов имеет вид

где п – концентрация молекул, т. е. число молекул в единице объема; W 0 – кинетическая энергия поступательного движения одной молекулы, движущейся со средней скоростью; m 0 – масса одной молекулы, V кв – среднеквадратичная скорость молекул газа.
Эти величины определяются следующими формулами:
- Число молекул в единице объема

- Средняя кинетическая энергия поступательного движения одной молекулы
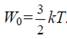
- Средняя квадратичная скорость молекул
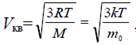
где m 0 = М/NA – масса одной молекулы; k = R/NA = 1,38∙10–23 Дж/К – постоянная Больцмана; NA = 6,02∙1023 моль–1 – постоянная Авогадро.
Энергия теплового движения всех молекул газа – внутренняя энергия идеального газа
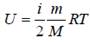
Изменение внутренней энергии газа

где i – число степеней свободы молекул; dT – изменение температуры газа.
Количество теплоты, полученное или отданное при процессах, равно
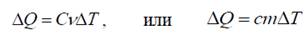
Связь между молярной С и удельной с теплоемкостями следует из их определения:
C = Mc
Молярная теплоемкость газа при постоянном объеме

Молярная теплоемкость при постоянном давлении

Первое начало термодинамики может быть записано в виде
δ Q = dU+ δ A,
где δ Q – количество теплоты, полученное газом; dU – изменение внутренней энергии газа; δ A = pdV – элементарная работа, совершаемая газом.
Полная работа газа равна
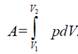
Работа, совершаемая при различных изопроцессах, получается применением этого интеграла к каждой конкретной задаче. Работу при адиабатическом процессе проще всего и удобнее находить, применяя для этого процесса первое начало термодинамики, т. е. Δ A = – Δ U.
Уравнение адиабатического процесса (уравнение Пуассона)

где показатель адиабаты γ = сp /сV.
Уравнение Пуассона через другие параметры системы может быть записано еще в таком виде:

Или
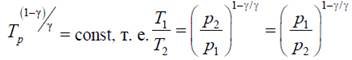
 2020-06-30
2020-06-30 91
91








