ВАРИАНТ № 8
| ТЕМА | ЗАДАНИЕ |
| Тема 1. Периодическая система элементов строение атома | Задание 1. Окончание электронной формулы ……3d14s21.Укажите положение элемента в периодической системе: период, группу, подгруппу, назвать элемент. Составьте электронную формулу атома элемента. Укажите электронное семейство, металл или неметалл. Составьте электронно-графическую формулу для указанных электронов в нормальном состоянии. |
| Задание 2. Указать все квантовые числа для электронов, отвечающих следующей электронной формуле 2p2 | |
| Тема 2. Кислотно-основные свойства веществ | Задание.Составьте уравнения реакций, при помощи которых можно осуществить следующие превращения C ® CO2 ® K2CO3 ® KHCO3® K2CO3 |
| Тема 3. Химическая термодинамика | Задание 1. Для реакции MgCO3(K) = MgO(K) + CO2(Г) определите возможное направление самопроизвольного течения реакции при стандартных условиях и при температуре t =6270C, если тепловой эффект до заданной температуры не изменится. Укажите: а) выделяется или поглощается энергия в ходе реакции; б) причину найденного изменения энтропии. Рассчитайте температуру, при которой устанавливается равновесие и происходит смена знака DG. Задание 2.Вычислите тепловой эффект реакции 4FeS2(K) + 11O2(Г) = 2Fe2O3(K) + 8SO2(Г) пользуясь стандартными энтальпиями образования реагирующих веществ (приложение 3). Сколько теплоты выделится (поглотится) при образовании вещества SO2 в количестве 89,6 л.? |
| Тема 4. Химическая кинетика и химическое равновесие | Задание 1. Определите, как изменится скорость реакции 2СО(г) + О2(г) = 2СО2(г), когда прореагирует 40 % кислорода, если начальные концентрации реагирующих веществ равны, моль/л: Со(СO)=0,8, 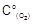 =0,6.
Задание 2.Для обратимой реакции N2O4(г) = 2NO2(г) запишите выражение константы равновесия ΔН°, кДж = + 57. Предложите способы увеличения концентрации продуктов реакции. =0,6.
Задание 2.Для обратимой реакции N2O4(г) = 2NO2(г) запишите выражение константы равновесия ΔН°, кДж = + 57. Предложите способы увеличения концентрации продуктов реакции.
|
| Тема 5. Растворы | Задание 1. Вычислите молярную, нормальную концентрации и титр 10%-го раствора сульфата магния. Плотность раствора 1,103 г/мл. Задание 2. Составьте молекулярные и ионно-молекулярные уравнения реакций, протекающих в растворах между следующими веществами: сульфатом меди (II) и соляной кислотой; гидроксидом алюминия и гидроксидом калия; сульфатом магния и карбонатом калия; ацетатом свинца (II) и серной кислотой; гидроксидом аммония и сульфатом железа (II). Задание 3. Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей K3PO4, MnBr2, Ba(NO3)2. Какое значение рН (>7, <7) имеют растворы этих солей? |
| Тема 6. Окислительно-восстановительные свойства веществ | Задание. Методом электронного баланса подберите коэффициенты в уравнениях, укажите окислитель и восстановитель, напишите электронные уравнения процессов окисления и восстановления NaBr + MnO2 + H2SO4 = MnSO4 + Na2SO4 + Br2 + H2O (NH4)2Cr2O7 = Cr2O3 + N2 + H2O |
| Тема 7. Электрохимические системы | Задание 1.Для гальванического элемента, образованного пластинами из металлов Ag и Cu, погруженных в растворы их солей с концентрацией ионов металлов An+ =0,10 и Bm+ = 0,03. 1) составьте схему гальванического элемента; 2) напишите уравнения электродных процессов и токообразующей реакции; 3) рассчитайте электродвижущую силу гальванического элемента. Задание 2.Составьте уравнения электродных процессов (анод инертный) и молекулярное уравнение реакции, проходящей при электролизе расплава или раствора электролита раствор ZnCl2. Вычислите массу металла выделившегося на катоде, если электролиз проводили при силе тока А =2,0. в течение времени = 50 мин. Выход металла по току ВТ составил 60%. Задание 3.Составьте уравнения электродных процессов и молекулярное уравнение реакции, протекающей при электрохимической коррозии гальванопары: Fe - Cu а) в кислой среде; б) в атмосфере влажного воздуха. |
Тема 1.
Периодическая система элементов строение атома
Задание 1. Окончание электронной формулы ……3d14s2.Укажите положение элемента в периодической системе: период, группу, подгруппу, назвать элемент. Составьте электронную формулу атома элемента. Укажите электронное семейство, металл или неметалл. Составьте электронно-графическую формулу для указанных электронов в нормальном состоянии.
Решение:
Так как внешний энергетический уровень атома четвертый, элемент находится в четвертом периоде. Общее число электронов равно 3, следовательно, элемент находится в 3 группе. Так как заполняется d-подуровень, то элемент расположен в побочной подгруппе. В таблице элементов Д.И.Менделеева находим, что это элемент № 21 – скандий. Заряд ядра равен +21, общее число электронов - 21. скандий относится к d-семейству, т.к. последним заполняется d-подуровень. Скандий проявляет металлические свойства.
Электронная формула атома:
1s 22s 22p 63s 23p64s 23d1
Электронно-графическая формула для валентных:
n=4 ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓
4s 4p 4d
n=3 ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓
3s 3p 3d
Задание 2. Указать все квантовые числа для электронов, отвечающих следующей электронной формуле 2p2
Решение:
Из электронной формулы следует: на внешнем 2p2 - подуровне имеется 4 электронов
№ электрона 1 2
n 2 2
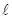 1 1
1 1
m l -1 0
m s + ½ +½
Тема 2.
 2020-06-30
2020-06-30 575
575







