Решение:
Составим схему ГЭ:
(–) Cu | Cu2+ || Ag+ | Ag (+)
анод катод
медный электрод имеет меньшее значение потенциала, чем серебряный, поэтому он будет анодом.
 А(–): Cu0 - 2
А(–): Cu0 - 2  = Cu2+ 1
= Cu2+ 1
К(+): Ag+ + 1  = Ag0 2
= Ag0 2
 Суммарная
Суммарная
реакция Cu0 + 2Ag+ = Cu2+ + 2Ag0
Рассчитаем потенциалы электродов при заданных концентрациях ионов по уравнению:

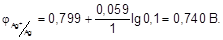
Определим ЭДС гальванического элемента по уравнению:

Задание 2. Составьте уравнения электродных процессов (анод инертный) и молекулярное уравнение реакции, проходящей при электролизе расплава или раствора электролита раствор ZnCl2.
Вычислите массу металла выделившегося на катоде, если электролиз проводили при силе тока А =2,0. в течение времени = 50 мин. Выход металла по току ВТ составил 60%.
Решение:
При электролизе расплава ZnCl2на катоде будут восстанавливаться ионы Zn2+, а на аноде – окисляться ионы Cl- с образованием газообразного хлора
 |
Катод (–): Zn2+ + 2 ē ® Zn 1
Анод (+): 2Cl- - 2 ē ® Cl2 1
 |
Суммарная реакция: ZnCl2 ® Zn + Cl2
Рассчитаем массу кадмия, выделившейся на катоде, по формуле:

Задание 3. Составьте уравнения электродных процессов и молекулярное уравнение реакции, протекающей при электрохимической коррозии гальванопары: Fe - Cu
А) в кислой среде;
Б) в атмосфере влажного воздуха.
Решение:
Исходя из положения металлов в ряду стандартных электродных потенциалов (приложение 6), железо более активный металл и в образующейся гальванической паре будет анодом, а медь - катодом.
железо будет окисляться, а на поверхности меди в кислой среде будет выделяться водород, в атмосферной среде – гидроксид-ионы.
Схема коррозии в среде HCl:
 А(–): Fe - 2 ē ® Fe2+ 1
А(–): Fe - 2 ē ® Fe2+ 1
К(+): 2H+ + 2 ē ® H2 1
 |
Fe + 2H+ ® Fe2+ + H2
Fe + 2HCl ® FeCl2 + H2
Схема коррозии в атмосфере влажного воздуха:
 А(–):Fe - 2 ē ® Fe2+ 2
А(–):Fe - 2 ē ® Fe2+ 2
К(+): O2 + 2H2O + 4 ē ® 4OH– 1
 |
2Fe + O2 + 2H2O ® 2Fe2+ + 4OH–
2Fe + O2 + 2H2O ® 2Fe(OH)2
Ионы Fe2+, образующиеся в результате коррозии железа, в кислой среде образуют с ионами Cl– хлорид железа FеCl2, в атмосфере – гидроксид железа Fe(OH)2 окисляется в Fe(OH)3: 4Fe(OH)2 + O2 + 2Н2O = 4Fe(OH)3, который частично теряет воду и превращается в ржавчину.
 2020-06-30
2020-06-30 945
945







