При расчетах этим способом используются расчетные данные для зависимости скорости реакции от времени. На опыте получают зависимость концентрации от времени (кинетическую кривую). Скорость реакции определяется по графику этой зависимости при помощи графического дифференцирования. Тангенс угла наклона касательных, проведенных в разных точках к кинетической кривой, равен производной от концентрации по времени, т. е. равен скорости реакции по данному веществу в данный момент времени. Скорость реакции по данному веществу, например по веществу А1 равна
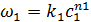
Прологарифмировав это уравнение получаем

На графике в координатах  опытные точки для различных моментов времени, в случае справедливости уравнения, должны располагаться на прямой линии. Отрезок на оси ординат на этом графике дает значение ln k1, а тангенс угла наклона прямой равен порядку реакции n1 по веществу А1. Точно также можно определить к2 и n2.
опытные точки для различных моментов времени, в случае справедливости уравнения, должны располагаться на прямой линии. Отрезок на оси ординат на этом графике дает значение ln k1, а тангенс угла наклона прямой равен порядку реакции n1 по веществу А1. Точно также можно определить к2 и n2.
Если точки, найденные по опытным данным, не располагаются на прямой, то это указывает на то, что уравнение не соответствует опытным данным, т. е. скорость реакции зависит от концентрации рассматриваемого вещества по более сложной зависимости.
ИНТЕГРАЛЬНЫЕ СПОСОБЫ
Способ подстановки
Суть данного способа состоит в подстановке экспериментальных данных по концентрации веществ для каждого момента времени от начала реакции в кинетические уравнения реакций различных порядков. Порядок реакции соответствует тому кинетическому уравнению, для которого при различных начальных концентрациях исходных веществ и в различные моменты времени при заданной температуре величина константы скорости будет оставаться постоянной.
Графический способ
Перепишем кинетические уравнения для реакций различных порядков в следующем виде




По опытным данным строят графики в координатах c - t; ln c - t;
 ;
; 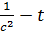 .
.
Каждое кинетическое уравнение дает прямую линию только в соответствующих координатах. Если, например, опытные точки расположились на прямой линии на графике в координатах ln c - t, а на других графиках получились кривые, то это указывает на то, что рассматриваемая реакция — реакция первого порядка. По угловому коэффициенту этой прямой можно определить константу скорости реакции.
 2020-07-01
2020-07-01 120
120








