Подставляя c = 0,5c0 в кинетические уравнения для различных порядков получаем
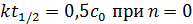
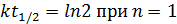
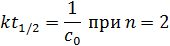
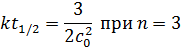
Проводим несколько опытов при различных начальных концентрациях и определяем время полураспада исследуемого исходного вещества. Как видно из этих уравнений, при n = 0 время полураспада зависит от начальной концентрации исследуемого вещества в первой степени, при n = 1 — не зависит от начальной концентрации, при n = 2 — зависит от начальной концентрации в степени (-1), при n = 3 — в степени (-2). Таким образом, по характеру зависимости t1/2 от с0 можно легко определить порядок реакции по веществу.
В общем случае, для реакции n -го порядка, зависимость периода полураспада от начальной концентрации исходного вещества имеет вид
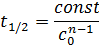
где const зависит от ПИ может быть легко определено для любого n. Прологарифмировав это уравнение при двух значениях c0 и t1/2 и вычтя из второго первое, после небольших преобразований получим выражение
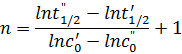
Вместо времени, за которое прореагирует половина исходного вещества,можно брать время, за которое прореагирует 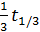 ,
, 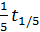 и т. д. исходного количества вещества.
и т. д. исходного количества вещества.
МЕТОД ВАНТ-ГОФФА
Проводя реакцию с двумя различными концентрациями одного из компонентов (с использованием метода изолирования Оствальда), или берут все вещества в эквивалентных концентрациях и проводят опыт с различными начальными концентрациями c01 и c02. Тогда получаем выражение
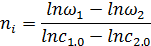
где ni — частный порядок по компоненту, начальная концентрация которого с0;
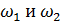 — истинные скорости реакции, соответствующие начальным концентрациям с1.0 и с2,0.
— истинные скорости реакции, соответствующие начальным концентрациям с1.0 и с2,0.
ПРАКТИЧЕСКАЯ ЧАСТЬ
 2020-07-01
2020-07-01 706
706








