Тема 5. Свойства оснований, кислот, солей
Основания – это гидроксиды вида Kat n +(OH) n –, где Kat n + – катион металла Me n + или аммония NH4+. Группы OH– – гидроксид-ионы, способны отделятся при диссоциации, а в реакциях – замещаться на кислотные остатки. Рассмотрим свойства оснований.
1. Диссоциация.
Все основания в водном растворе диссоциируют на катионы металла или аммония и группы ОН–.
Сильные основания распадаются практически полностью, всегда в одну ступень:
KOH = K+ + OH–
Ca(OH)2 = Ca2+ + 2OH–
Слабые основания распадаются незначительно, например:
 NH4OH NH4+ + OH–
NH4OH NH4+ + OH–
Нужно запомнить, что форма записи гидрата аммиака в виде гидроксида аммония считается устаревшей, лучше записывать тот же процесс следующим образом:
 NH3·H2O NH4+ + OH–
NH3·H2O NH4+ + OH–
Если у основания несколько групп ОН (оно является многокислотным), то такое основание диссоциирует ступенчато, например:
 Al(OH)3 Al(OH)2+ + OH–
Al(OH)3 Al(OH)2+ + OH–
 Al(OH)2+ Al(OH)2+ + OH–
Al(OH)2+ Al(OH)2+ + OH–
 Al(OH)2+ Al3+ + OH–
Al(OH)2+ Al3+ + OH–
2. Взаимодействие с кислотами.
Реакция между основанием и кислотой, приводящая к образованию соли и воды, называется реакция нейтрализации.
Пример 3. Составить реакцию ионного обмена между гидроксидом натрия и серной кислотой, записать ее молекулярное, полное и сокращенное ионное уравнение.
Решение. Это реакция нейтрализации – гидроксид ионы будут замещаться на кислотные остатки, или, иначе, ионы водорода в кислоте – на ионы металлов. Запишем молекулярное уравнение. Будем считать, что все ионы водорода в кислоте будут замещены на ионы металлов, образуется средняя соль (иного не указано):
2NaOH + H2SO4 = Na2SO4 + 2H2O
В молекулярных уравнениях все вещества записываем в виде молекул. Составим полное ионное уравнение. Оно отражает реальное состояние вещества в растворе: сильные электролиты представлены в виде ионов, слабые – в основном в виде молекул, в данной реакции оба исходных вещества относятся к сильным электролитам, сульфат натрия сильный электролит (растворимая соль), вода – слабый электролит, именно из-за образования воды реакция возможна:
2Na+ + 2OH– + 2H+ + SO42– = 2Na+ + SO42– + 2H2O
Видно, что часть ионов (Na+ + SO42–) непосредственно в реакции не участвуют, а реакция сводится к взаимодействию:
OH– + H+ = H2O
Это и будет сокращенное ионное уравнение, формально оно может быть получено из полного ионного уравнения вычеркиванием (сокращением) одинаковых ионов в левой и правой части. Обратим внимание, что в сокращенных уравнениях коэффициенты, по возможности, следует сокращать.
Пример 4. Составить реакцию ионного обмена между гидратом аммиака и соляной кислотой, записать ее молекулярное, полное и сокращенное ионное уравнение.
Решение. Реакция отличается от предыдущей тем, что раствор аммиака (гидрат аммиака) является слабым основанием, его в ионных уравнениях следует записывать в неизменном виде. Приведем без дополнительных пояснений:
NH3·H2O + HCl = NH4Cl + H2O
NH3·H2O + H+ + Cl– = NH4+ + Cl– + H2O
NH3·H2O + H+ = NH4+ + H2O
3. Взаимодействие с кислотными оксидами (см. раздел свойства кислотных оксидов).
4. Взаимодействие с амфотерными оксидами и гидроксидами возможно только для сильных растворимых оснований (щелочей). В растворе образуются комплексные соединения, при сплавлении – соли, содержащие амфотерный металл в анионе.
Пример 5. Составить реакцию ионного обмена между гидроксидом калия и гидроксидом бериллия, записать ее молекулярное, полное и сокращенное ионное уравнение. Записать эту же реакцию при сплавлении.
Решение. Гидроксид бериллия – слабое основание, комплексный ион устойчив в растворе:
2KOH + Be(OH)2 = K2[Be(OH)4]
2K+ + 2OH– + Be(OH)2 = 2K+ + [Be(OH)4]2–
2OH– + Be(OH)2 = [Be(OH)4] 2–
При сплавлении:
2KOH + Be(OH)2 = K2BeO2 + 2H2O
Реакция идет не в растворе, ионные уравнения неуместны.
5. Взаимодействие с некоторыми металлами: цинк, алюминий, бериллий – достаточно активные амфотерные металлы – растворяются в водных растворах щелочей, образуются комплексные соли, выделяется газ водород, например:
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
Zn + 2NaOH + 2Н2O = Na2[Zn(OH)4] + H2
В концентрированных растворах щелочей растворяются олово и свинец, также образуются комплексные соли.
6. Разложение (потеря воды) при нагревании – разлагаются только нерастворимые гидроксиды и LiOH:
2LiOH 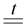 Li2O + H2O
Li2O + H2O
Ca(OH)2 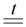 CaO +H2O
CaO +H2O
2Fe(OH)3 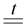 Fe2O3 + 3H2O
Fe2O3 + 3H2O
7. Многие гидроксиды d -элементов растворяются в гидрате аммиака (см. также раздел 3, стр. 64 данного пособия).
Именно с помощью водного раствора аммиака можно различить свежеосажденные гидроксиды цинка и алюминия:
Zn(OH)2 + 4NH3·H2O = [Zn(NH3)4](OH)2 +4H2O
Запишем это уравнение в ионном виде:
Zn(OH)2 + 4NH3·H2O = [Zn(NH3)4]2+ + 2OH– +4H2O
Обратим внимание, что полное и сокращенное уравнение здесь одинаковы – до и после реакции нет одинаковых ионов.
 2020-07-12
2020-07-12 249
249







