Соли – сложные вещества, состоящие из катионов металла или аммония и анионов кислотных остатков.
1. Диссоциация. Все растворимые соли – сильные электролиты, в растворе нацело распадаются на катионы и анионы, например:
Na3PO4 = 3Na+ + PO43–
NH4Cl = NH4+ + Cl–
KAl(SO4)2 = K+ + Al3+ + 2SO42–
2. Взаимодействие раствора соли и металла.
Более активный металл (стоящий левее в ряду активности) вытесняет менее активный из раствора его соли, например:
ZnSO4 + Mg = MgSO4 + Zn
NiSO4 + Zn = ZnSO4 + Ni
CuCl2 + Fe = FeCl2 + Cu
На этом правиле построено много заданий, но нужно отметить, что существуют похожие окислительно-восстановительные реакции, на первый взгляд противоречащие этому правилу, например:
FeCl3 + Cu = CuCl2 + FeCl2
3. Соли вступают в реакции ионного обмена со щелочами, кислотами, другими солями, например:
AlBr3 + 3NaOH = Al(OH)3¯ + 3NaBr
NH4Cl + KOH = NH4OH + KCl
K2S + 2HCl = 2KCl + H2S
NaHCO3 + HNO3 = NaNO3 + H2O + CO2
K2SO4 + Ba(NO3)2 = 2KNO3 + BaSO4¯
AgNO3 + KCl = AgCl¯ + KNO3
4. Кислые и основные соли переходят в средние под действием соответствующих оснований и кислот, например:
NaHCO3 + NaOH = Na2CO3 + H2O
(CuOH)2SO4 + H2SO4 = 2CuSO4 + 2H2O
5. Гидроксокомплексы (комплексные соли) устойчивы в щелочной среде, но распадаются под действием кислот и кислотных оксидов:
Na2[Zn(OH)4] + 2HCl (по каплям) = Zn(OH)2¯ + 2NaCl + 2H2O
Na2[Zn(OH)4] + 4HCl (избыток) = ZnCl2¯ + 2NaCl + 4H2O
Na[Al(OH)4] + CO2 = Al(OH)3¯ + NaHCO3
6. Соли участвуют в окислительно-восстановительных реакциях, многие соли являются популярными окислителями и восстановителями, например: KMnO4, K2Cr2O7, FeCl3, KI, Na2SO3. Их свойства будут рассмотрены далее.
7. Разложение солей при нагревании.
а) Кислородсодержащие соли распадаются при нагревании, некоторые популярные реакции приведены ниже:
CaCO3 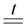 CaO + CO2
CaO + CO2
2AlPO4 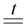 Al2O3 +P2O5
Al2O3 +P2O5
2Zn(NO3)2  2ZnO + 4NO2 + O2
2ZnO + 4NO2 + O2
Fe2(SO4)3 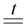 Fe2O3 + 3SO3
Fe2O3 + 3SO3
2CuSO4 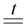 2CuO + 2SO2 + O2
2CuO + 2SO2 + O2
Na2SO3  Na2S + Na2SO4
Na2S + Na2SO4
2NaHCO3 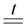 Na2CO3 + CO2 + H2O
Na2CO3 + CO2 + H2O
4K2Cr2O7  4K2CrO4 + 2Cr2O3 + 3O2
4K2CrO4 + 2Cr2O3 + 3O2
2KMnO4  K2MnO4 + MnO2 + O2
K2MnO4 + MnO2 + O2
4KClO3 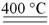 3KClO4 + KCl
3KClO4 + KCl
2KClO3 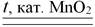 2KCl + 3O2
2KCl + 3O2
б) Указанные выше реакции являются специфическими. Отдельно выделим разложение нитратов металлов при нагревании – это обязательно нужно запомнить.
Продукты разложения нитратов зависят от активности металла:
– если металл стоит в ряду активности до магния (кроме лития), при нагревании его нитрата образуется нитрит металла и газ кислород, например:
2KNO3 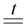 2KNO2 + O2
2KNO2 + O2
– металлы в ряду активности от магния до меди и литий: их нитраты разлагаются на оксид металла, оксид азота (IV) и газ кислород, например:
4LiNO3 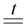 2Li2O + 4NO2 + O2
2Li2O + 4NO2 + O2
2Mg(NO3)2 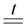 2MgO + 2NO2 + 3O2
2MgO + 2NO2 + 3O2
2Cu(NO3)2 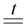 2CuO + 2NO2 + 3O2
2CuO + 2NO2 + 3O2
– нитраты металлов, стоящие в ряду активности правее меди разлагаются на металл, оксид азота (IV) и газ кислород, например:
2АgNO3 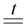 2Ag + 2NO2 + O2
2Ag + 2NO2 + O2
в) разложение солей аммония при нагревании.
Если анион кислотного остатка не является сильным окислителем, то такие соли аммония при нагревании разлагаются на аммиак и кислоту, например:
NH4Cl 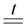 NH3 + HCl
NH3 + HCl
(NH4)2S 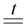 2NH3 + H2S
2NH3 + H2S
(NH4)2SiO3 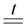 2NH3 + SiO2 + H2O
2NH3 + SiO2 + H2O
(NH4)2SO3 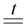 2NH3 + SO2 + H2O
2NH3 + SO2 + H2O
Если анион – окислитель, то азот окисляется. Следующие реакции необходимо запомнить:
NH4NO3 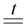 N2O + 2H2O
N2O + 2H2O
NH4NO2  N2 + 2H2O
N2 + 2H2O
(NH4)2Cr2O7 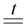 N2 + Cr2O3 + 4H2O
N2 + Cr2O3 + 4H2O
8. Гидролиз солей – обратимая реакция ионного обмена между ионами растворенной соли и водой. Теме «Гидролиз соли, среда водных растворов» посвящена задача 23, но гидролиз солей, в том числе и совместный, встречается и в других заданиях, например, в 32. От абитуриента требуется:
– уметь определять, возможен ли гидролиз данной соли; вид гидролиза; характер среды водного соли; составить и уравнять реакцию совместного гидролиза двух солей;
– знать окраску распространенных индикаторов в различных средах; способы усиления гидролиза.
Из-за большого объема информации, обычно тему «Гидролиз солей, среда водных растворов» рассматривают отдельно от свойств солей.
 2020-07-12
2020-07-12 102
102








