Кислоты – это сложные вещества, катионами в которых являются только ионы водорода. Общая формула кислот H+ m A– m , где A– m – анион кислотного остатка. Ионы H+ способны отделятся при диссоциации, а в реакциях – замещаться на ионы металлов или аммония. Рассмотрим свойства кислот.
1. Диссоциация.
Все кислоты в водном растворе диссоциируют на катионы H+ и анионы кислотных остатков.
Сильные кислоты распадаются практически полностью, всегда в одну ступень:
HCl = H+ + Cl–
H2SO4 = 2H+ + SO42–
Слабые кислоты распадаются незначительно, например
HF = H+ + F–
Если у кислоты несколько ионов Н+ (она является многоосновной), то такая кислота диссоциирует ступенчато, например:
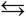 H3PO4 H+ + H2PO4–
H3PO4 H+ + H2PO4–
 H2PO4– H+ + HPO42–
H2PO4– H+ + HPO42–
 HPO42– H+ + PO43–
HPO42– H+ + PO43–
2. Взаимодействие с образованием солей с основными оксидами, основаниями, амфотерными оксидами и гидроксидами, гидратом аммиака. Ионы H+ полностью или частично замещаются на катионы металлов или аммония, например:
2HBr + CaO = CaBr2 + H2O
H3PO4 + NaOH = NaH2PO4 + H2O
2HCl + Mg(OH)2 = MgCl2 +2H2O
HCl + Mg(OH)2 = MgOHCl +H2O
2HNO3 + ZnO = Zn(NO3)2 + H2O
3HCl + Cr(OH)3 = CrCl3 + 3H2O
H2SO4 + NH3·H2O = NH4HSO4 + H2O
3. Более сильные кислоты вытесняют менее сильные из их солей, например:
3H2SO4 + Ca3(PO4)2 = 3CaSO4 + 2H3PO4
Если образующаяся кислота нерастворима, газообразна или легко распадается на газ и воду, то это взаимодействие практически необратимо, например:
Na2SiO3 + 2HCl = H2SiO3¯ + 2NaCl
K2S + H2SO4 = H2S + K2SO4
CaCO3 + 2HNO3 = H2O + CO2 + Ca(NO3)2
4. Взаимодействие с металлами.
а) Обычные кислоты (кислоты-неокислители, т.е. все кислоты, кроме азотной и концентрированной серной), реагируют с металлами, стоящими в ряду активности до водорода, с образованием соли и газа H2, например:
Zn + 2HCl = ZnCl2 + H2
Fe + H2SO4 (разб.) = FeSO4 + H2
б) С кислотами-окислителями: азотной и концентрированной серной, металлы реагируют без выделения газа водорода. Здесь окислителем является не катион водорода, а более сильные окислители нитрат- и сульфат-ион, например:
4HNO3 + Cu = Cu(NO3)2 + 2NO2 + 2H2O
5H2SO4 (конц.) + 4Zn = 4ZnSO4 + H2S + 4H2O
5. Взаимодействие с бинарными соединениями.
В заданиях ЕГЭ встречаются реакции бинарных соединений (нитридов, карбидов, фосфидов) с водой и кислотами. Бинарные соединения щелочноземельных металлов неустойчивы и разлагаются водой, например:
CaC2 + 2H2O = Ca(OH)2 + C2H2
Mg3N2 + 6H2O = 3Mg(OH)2 + 2NH3
Ca3P2+ 6H2O = 3Ca(OH)2 + 2PH3
Аналогично идут реакции с кислотами, при этом образуется соль, а газообразный продукт может сам реагировать с кислотой:
CaC2 + 2HCl = CaCl2 + C2H2
Mg3N2 + 8HCl = 3MgCl2 + 2NH4Cl
Ca3P2+ 6HCl = 3CaCl2 + 2PH3
Обратим внимание, что в предпоследней реакции образуется соль аммония, так как аммиак имеет выраженные основные свойства, а в последней реакции газ фосфин остается неизменным.
 2020-07-12
2020-07-12 70
70








