Моносахариды, как правило, представляют собой твердые вещества, хорошо растворимые в воде, плохо - в спирте и нерастворимые в большинстве органических растворителей. Почти все моносахариды обладают сладким вкусом.Моносахариды могут существовать как в открытой (оксоформе), так и в циклических формах. В растворе эти изомерные формы находятся в динамическом равновесии.
Открытые формы. Моносахариды (монозы) являются гетерофункциональными соединениями. В их молекулах одновременно содержатся карбонильная (альдегидная или кетонная) и несколько гидроксильных групп, т. е. моносахариды представляют собой полигидроксикарбонильные соединения - полигидроксиальдегиды и полигидроксикетоны. Они имеют неразветвленную углеродную цепь.
Моносахариды классифицируют с учетом природы карбонильной группы и длины углеродной цепи. Моносахариды, содержащие альдегидную группу, называют альдозами, а кетонную группу (обычно в положении 2) - кетозами (суффикс -оза применяют для названий моносахаридов: глюкоза, галактоза, фруктоза и т. д.). В общем виде строение альдоз и кетоз можно представить следующим образом.
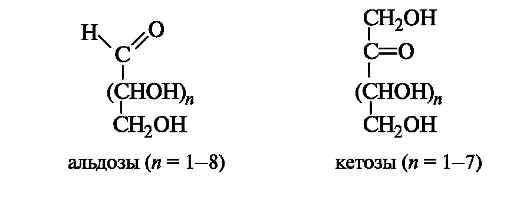
В зависимости от длины углеродной цепи (3-10 атомов) монос риды делят на триозы, тетрозы, пентозы, гексозы, гептозы и т. д. Наиболее распространены пентозы и гексозы.аха
Стереоизомерия. Молекулы моносахаридов содержат несколько центров хиральности, что служит причиной существования многих стереоизомеров, отвечающих одной и той же структурной формуле. Например, в альдогексозе имеются четыре асимметрических атома углерода и ей соответствуют 16 стереоизомеров (24), т. е. 8 пар энантиомеров. По сравнению с соответствующими альдозами кетогексозы содержат на один хиральный атом углерода меньше, поэтому число стереоизомеров (23) уменьшается до 8 (4 пары энантиомеров).
Открытые (нециклические) формы моносахаридов изображают в виде проекционных формул Фишера. Углеродную цепь в них записывают вертикально. У альдоз наверху помещают альдегидную группу, у кетоз - соседнюю с карбонильной первичную спиртовую группу. С этих групп начинают нумерацию цепи.

Для обозначения стереохимии используется D,L-система. Отнесение моносахарида к D- или L-ряду проводят по конфигурации хирального центра, наиболее удаленного от оксогруппы, независимо от конфигурации остальных центров! Для пентоз таким «определяющим» центром является атом С-4, а для гексоз - С-5. Положение группы ОН у последнего центра хиральности справа свидетельствует о принадлежности моносахарида к D-ряду, слева - к L-ряду, т. е. по аналогии со стереохимическим стандартом - глицериновым альдегидом.
Большинство природных моносахаридов принадлежит к D-ряду. Из альдопентоз часто встречаются D-рибоза и D-ксилоза, а из кетопентоз - D-рибулоза и D-ксилулоза.
Общие названия кетоз образуются введением суффикса -ул в названия соответствующих альдоз: рибозе соответствует рибулоза, ксилозе - ксилулоза (из этого правила выпадает название «фруктоза», которое не имеет связи с названием соответствующей альдозы).
Диастереомеры, различающиеся конфигурацией только одного асимметрического атома углерода, называются эпимерами. Эпимеры - частный случай диастереомеров. Например, D-глюкоза и D-галактоза отличаются друг от друга только конфигурацией атома С-4, т. е. являются эпимерами по С-4. Аналогично D-глюкоза и D-манноза - эпимеры по С-2, а D-рибоза и D-ксилоза - по С-3.
Каждой альдозе D-ряда соответствует энантиомер L-ряда с противоположной конфигурацией всех центров хиральности.

 Циклические формы. Моносахариды по строению являются циклическими полуацеталями. Образование циклических форм моносахаридов можно представить как результат внутримолекулярного взаимодействия карбонильной и гидроксильной групп, содержащихся в молекуле моносахарида.
Циклические формы. Моносахариды по строению являются циклическими полуацеталями. Образование циклических форм моносахаридов можно представить как результат внутримолекулярного взаимодействия карбонильной и гидроксильной групп, содержащихся в молекуле моносахарида.
Полуацетальную гидроксильную группу в химии углеводов называют гликозидной. По свойствам она значительно отличается от остальных (спиртовых) гидроксильных групп.
 В результате циклизации образуются термодинамически более устойчивые фуранозные (пятичленные) и пиранозные (шестичленные) циклы. Названия циклов происходят от названий родственных гетероциклических соединений - фурана и пирана.
В результате циклизации образуются термодинамически более устойчивые фуранозные (пятичленные) и пиранозные (шестичленные) циклы. Названия циклов происходят от названий родственных гетероциклических соединений - фурана и пирана.
Образование этих циклов связано со способностью углеродных цепей моносахаридов принимать достаточно выгодную клешневидную конформацию. Вследствие этого в пространстве оказываются сближенными альдегидная (или кетонная) и гидроксильная при С-4 (или при С-5) группы, т. е. те функциональные группы, в результате взаимодействия которых осуществляется внутримолекулярная циклизация. Если у альдогексоз в реакцию вступит гидроксильная группа при С-5, то возникает полуацеталь с шестичленным пиранозным циклом. Аналогичный цикл у кетогексоз получается при участии в реакции гидроксильной группы при С-6.

В циклической форме создается дополнительный центр хиральности - атом углерода, ранее входивший в состав карбонильной группы (у альдоз это С-1). Этот атом называют аномерным, а два соответствующих стереоизомера - α- и β-аномерами. Аномеры представляют собой частный случай эпимеров.
У α-аномера конфигурация аномерного центра одинакова с конфигурацией «концевого» хирального центра, определяющего принадлежность к D- или L-ряду, а у β-аномера - противоположна.
Формулы Хеуорса. Циклические формы моносахаридов изображают в виде перспективных формул Хеуорса, в которых циклы показывают в виде плоских многоугольников, лежащих перпендикулярно плоскости рисунка. Атом кислорода располагают в пиранозном цикле в дальнем правом углу, в фуранозном - за плоскостью цикла. Символы атомов углерода в циклах не указывают.

Для перехода к формулам Хеуорса циклическую формулу Фишера преобразуют так, чтобы заместители, находившиеся справа от вертикальной линии углеродной цепи, оказались под плоскостью цикла, а те, что были слева, - над этой плоскостью.Гликозидная гидроксильная группа у α -аномеров D-альдоз оказывается под плоскостью цикла, у β-аномеров - над плоскостью.
По аналогичным правилам осуществляется переход и у кетоз, что показано ниже на примере одного из аномеров фуранозной формы D-фруктозы.
2.2. Цикло-оксо-таутомерия

В кристаллическом состоянии все моносахариды находятся в циклической форме в виде α- или β-аномеров. При растворении моносахаридов в воде наблюдается так называемая цикло-оксо-таутомерия (кольчатоцепная таутомерия), т.е. устанавливается равновесие между циклическими таутомерами моносахаридов, различающихся по размеру цикла (фуранозный, пиранозный), α- и β-формами и открытой формой.
Конформации. Для пиранозной формы наиболее предпочтительна конформация кресла. Конформационное строение D-глюкопиранозы проливает свет на уникальность β-D-глюкопиранозы: единственный моносахарид с полным экваториальным расположением заместителей.
Благодаря такому строению β-глюкоза термодинамически устойчива, именно это и является причиной распространенности в-глюкозы в природе.
α-глюкоза отличается только расположением заместителей у аномерного центра (-ОН заместитель находится в аксиальном положении).
2.3. Химические свойства моносахаридов
Для моносахаридов характерны как реакции, свойственные спиртам, так и альдегидам.
Реакции, обусловленные спиртовыми группами.
1. Образование простых эфиров.
В реакции с алкилгалогенидами участвуют все гидроксильные группы, включая гликозидный гидроксил.
2. Образован и е сложных эфиров.
Сложные эфиры легко образуются при ацилировании ангидри-
дами кислот.
Из сложноэфирных производных наибольшее значение имеют эфирыфосфорной кислоты (фосфаты), они содержатся во всех растительных иживотных организмах, наибольшее значение имеют 6-фосфат, 1-фосфат глюкозы и 1,6-дифосфат фруктозы.
 2020-07-12
2020-07-12 668
668








