При логарифмировании уравнения 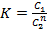 получаем уравнение прямой
получаем уравнение прямой
lgK = lgC1 – nlgC2, lgC1 = lgK + nlgC2
lgC1 = f (lgC2)
Экстракция
Распределение вещества между несмешивающимися растворителями лежит в основе экстракционного метода его извлечения. Экстракцией называют извлечение растворенного вещества из раствора с помощью другого растворителя.
Закон распределения позволяет рассчитать количество вещества, извлекаемого в серии экстракций.
Пусть раствор объемом V1, содержащий go экстрагируемого вещества, обрабатывают порциями экстрагента V2, коэффициент распределения С1/С2 = К, число экстракций n.
Количество вещества, остающегося после каждой экстракции, обозначим gi (g1, g2, g3, …). Тогда после однократной экстракции:
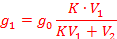
После п повторных экстракций одинаковым объемом V2 того же растворителя количество вещества gп, остающегося в исходном растворе, определяется уравнением:
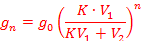
Количество экстрагированного вещества gэ составляет gэ = go – gп.
РАЗБАВЛЕННЫЕ РАСТВОРЫ НЕЛЕТУЧИХ ВЕЩЕСТВ.
КОЛЛИГАТИВНЫЕ СВОЙСТВА РАСТВОРОВ
Рассмотрим свойства разбавленных растворов нелетучих веществ, не являющихся электролитами. В этом случае можно считать, что для растворителя справедлив закон Рауля, а растворенное вещество этому закону не подчиняется.
Коллигативными называются свойства, которые зависят от природы растворителя, т.е. от числа его частиц в единице объема, но не зависят от свойств этих частиц.
Коллигативные свойства проявляются, когда в равновесии находятся 2 фазы, одна из которых содержит растворитель и растворенное вещество, а вторая – только растворитель.
Среди набора коллигативных свойств выделим основные:
1. понижение температуры замерзания растворов,
2. повышение температуры кипения растворов,
3. осмотическое давление.
Криоскопия
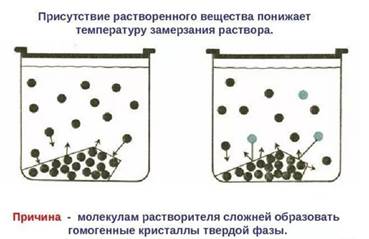
1. В отличие от чистой жидкости, раствор при охлаждении не замерзает целиком при постоянной температуре. При определенной температуре из раствора начинают выделяться кристаллы растворителя и, по мере охлаждения, количество их растет и наконец, весь раствор закристаллизовывается. Температурой кристаллизации (или замерзания) раствора считают температуру, при которой начинается образование кристаллов.
Замерзание растворов характеризуют величиной понижения температуры замерзания ∆Тзам, равной разности между температурой замерзания чистого растворителя Т°зам и температурой начала кристаллизации раствора Тзам:
∆Тзам = Т°зам – Тзам
Рассмотрим диаграмму состояния Р – Т растворителя и растворов различной концентрации (рис 4). Кривая ОF есть зависимость давления пара над твердым растворителем, а кривые ОА, ВС, DE – зависимости давления пара над чистым растворителем и растворами с возрастающими концентрациями соответственно. Кристаллы растворителя будут находиться в равновесии с раствором только тогда, когда давление насыщенного пара над кристаллами и над раствором одинаково.
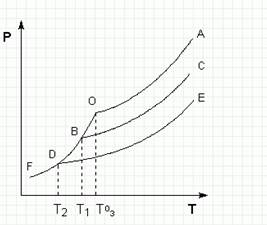
Рис 4 Понижение температуры замерзания разбавленных растворов
Поскольку давление пара растворителя над раствором всегда ниже, чем над чистым растворителем, температура, отвечающая этому условию, всегда будет более низкой, чем температура замерзания чистого растворителя. При этом понижение температуры замерзания раствора ∆ Тзам не зависит от природы растворенного вещества и определяется лишь соотношением числа частиц растворителя и растворенного вещества.
С увеличением концентрации раствора температура замерзания понижается – ∆Тзам прямо пропорционально моляльной концентрации раствора.
∆Тзам = К ∙ m,
уравнение называют вторым законом Рауля, где m – моляльная концентрация раствора,
К – коэффициент пропорциональности, криоскопическая постояннаярастворителя, определяется природой растворителя. Физический смысл криоскопической постоянной: К равна понижению температуры замерзания одномоляльного раствора если m = 1 тогда ∆Тзам = К.
Криоскопия – (от греческого «криос» – холод)явление понижения температуры замерзания раствора по сравнению с чистым растворителем. Явление криоскопии используется для определения молекулярной массы растворенного вещества.
Благодаря тому, что температура замерзания растворов ниже, чем температура замерзания индивидуальных жидкостей, растворы используют в качестве хладоносителей – жидкостей которые охлаждают до низких температур и подают по трубам к месту потребления холода. Например, водные растворы пропиленгликоля, их температура замерзания ниже –50°С. Также используют NaCl, CaCl2, этиленгликоль, но они вызывают коррозию труб.
Также биологические жидкости, как молоко и кровь, являющиеся многокомпонентными растворами, замерзают при температуре ниже 0°С. Температура замерзания нормального коровьего молока находится в пределах (–0,54°С) – (–0,58°С). Отклонения от этой температуры указывает на разбавление молока водой.
Эбулиоскопия
2. Рассмотрим Р – Т диаграмму состояния растворителя и растворов различной концентрации (рис. 5). Любая жидкость кипит при такой температуре, при которой давление ее насыщенного пара равно внешнему давлению. Соответственно температуры, при которых изобара Р = 1 атм пересечет кривые ОА, ВС, DE, представляющие собой зависимости давления пара над чистым растворителем и растворами с возрастающими концентрациями соответственно, будут температурами кипения этих жидкостей.
Раствор кипит при температуре более высокой, чем чистый растворитель. С увеличением концентрации раствора температура кипения повышается. Повышение температуры кипения пропрционально понижению давления насыщенного пара и, следовательно, прямо пропорционально моляльной концентрации раствора:
∆Ткип = Е ∙ m,
где ∆Ткип = Ткип раствора – Т°кип растворителя, m – моляльная концентрацияраствора, Е – коэффициент пропорциональности, эбуллиоскопическая постоянная растворителя, зависит от природы растворителя. Физический смысл эбуллиоскопической постоянной: Е есть повышение температуры кипения одномоляльного раствора - m = 1 тогда ∆Ткип = Е.
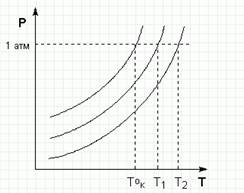
Рис 5 Повышение температуры кипения разбавленных растворов
Эбуллиоскопия – (от латинского «эбулиос» - вскипать) явление повышения температуры кипения раствора по сравнению с чистым растворителем.
Явление эбуллиоскопии используется для определения молекулярной массы растворенного вещества.
Т.о., второй закон Рауля можно сформулировать следующим образом:
Понижение температуры замерзания и повышение температуры кипения разбавленного раствора нелетучего вещества прямо пропорционально моляльной концентрации раствора и не зависит от природы растворенного вещества.
Второй закон Рауля является следствием из первого, данный закон справедлив только для бесконечно разбавленных растворов.
Явление осмоса
Возьмем сосуд, разделенный точно пополам полупроницаемой перегородкой, которая не доходит до конца сосуда и отделяет растворитель от раствора, имеющих постоянную и одинаковую температуру (рис. 6). Через перегородку могут проходить молекулы растворителя и не проходят молекулы растворенного вещества. Будет наблюдаться явление самопроизвольного перехода растворителя через мембрану из менее концентрированного раствора в более концентрированный – явление осмоса.
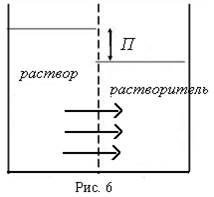 Благодаря осмосу уровень раствора установится выше уровня растворителя.
Благодаря осмосу уровень раствора установится выше уровня растворителя.
Осмотические свойства раствора количественно характеризуются величиной осмотического давления. Сила, заставляющая переходить растворитель через мембрану в раствор называется осмотическим давлением П. Величина осмотического давления определяется по уравнению Вант-Гоффа:
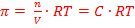 , (Па)
, (Па)
где С – молярная концентрация раствора.
Уравнение Вант-Гоффа показывает, что осмос и вызванное им осмотическое давление зависят от количества растворенного вещества (n) и температуры раствора.
 2020-07-12
2020-07-12 239
239







