При заданной температуре общее давление раствора складывается из парциальных давлений, образующих его компонентов.
Парциальное давление – давление отдельно взятого компонента газовой смеси. Общее давление смеси является суммой парциальных давлений ее компонентов.
Например, раствор образован компонентами А и В, тогда общее давление Р =РА + РВ.
На зависимость общего и парциального давлений от концентрации индивидуальные физико-химические свойства компонентов влияют по разному. На этом основании различают 3 группы растворов:
1. Идеальные – раствор, в котором силы взаимодействия между молекулами разных видов равны силам взаимодействия между молекулами одного вида, т.е. в условной записи FA–B = FA–A = FB–B
Идеальные растворы могут образовываться из веществ, молекулы которых сходны по полярности, строению и химическому составу. Например, бензол – толуол, гексан – гептан и др. смешение таких веществ происходит без поглощения или выделения теплоты, т.е. ∆Н = 0 и без изменения объема, ∆V = 0, т.е. так, что объем полученного раствора равен сумме объемов компонентов.
Поведение идеального раствора подобно поведению идеального газа, зависит только от концентрации компонентов и температуры.
Для идеальных растворов выполняется закономерность, называемая законом Рауля. Pi = Piо ∙ Niж
Уравнение является выражением закона Рауля, согласно которому: при постоянной температуре равновесное парциальное давление пара Pi каждого компонента равно давлению пара Piо этого компонента в чистом виде при данной температуре, помноженному на его мольную долю Niж в жидкой фазе (в растворе).
Зависимость парциальных и общего давлений пара от состава для идеального раствора имеет линейный характер и можно представить графически (рис 1):
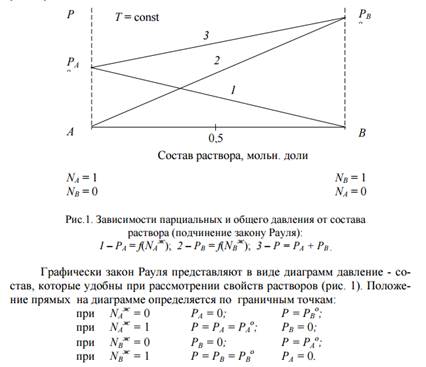
2. Реальные – растворы, в которых силы взаимодействия между молекулами разных видов не равны силам взаимодействия между молекулами одного вида, т.е. FA–A ≠ FA–B ≠ FB–B
При образовании реального раствора ∆Н ≠ 0 и ∆V ≠ 0. В реальных системах наблюдаются отклонения от закона Рауля, вызываемые взаимодействием молекул.
Рассмотрим 2 типа отклонений от закона Рауля:
1. Если FB–B > FA–B < FA–A, FA–B < (FB–B ≈ FA–A), т.е. силы взаимодействия между однородными молекулами больше силы взаимодействия между разнородными молекулами, то требуется меньшая затрата энергии для перевода в пар молекул В, окруженных молекулами А, или молекул А, окруженных молекулами В, такой раствор образуется из чистых компонентов с поглощением теплоты ∆Н > 0 и с увеличением объема системы при растворении ∆V > 0. Вследствие увеличения числа частиц в растворе, парциальные давления (и общее давление пара) оказываются больше, рассчитанных по уравнению Рауля. Это положительные отклонения от закона Рауля, (рис.2)
Pi > Piо ∙ Niж
Для реальных растворов зависимости общего и парциального давлений пара от состава раствора имеют нелинейный характер, например вода – метанол, ацетон – этанол, ацетон - сероуглерод:
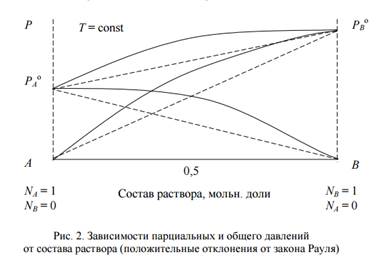 В этом случае облегчается переход молекул из жидкой фазы в газообразную по сравнению с чистыми жидкостями и затрудняется образование растворов. Положительные отклонения наблюдаются при различной полярности компонентов раствора и наличии в исходных жидкостях ассоциатов. В случае больших положительных отклонений, жидкости могут расслаиваться.
В этом случае облегчается переход молекул из жидкой фазы в газообразную по сравнению с чистыми жидкостями и затрудняется образование растворов. Положительные отклонения наблюдаются при различной полярности компонентов раствора и наличии в исходных жидкостях ассоциатов. В случае больших положительных отклонений, жидкости могут расслаиваться.
2. Если FB–B < FA–B > FA–A, FA–B > (FB–B ≈ FA–A), то разные виды молекул стремятся к взаимодействию типа притяжения, т.е. энергия (сила) взаимодействия разнородных молекул больше, чем однородных. В этом случае затрудняется переход молекул в газообразную фазу и облегчается образование растворов. Это наблюдается при наличии тенденции к химическому взаимодействию между разнородными молекулами, приводящей к возникновению химических соединений, образованию водородных связей и сольватов. При этом образование сопровождается выделением теплоты ∆Н < 0 и уменьшением объема, ∆V < 0. Уменьшение числа частиц в растворе, по сравнению с их числом в чистых компонентах, приводит к уменьшению парциальных давлений пара компонентов. Это отрицательные отклонения от закона Рауля, например вода – соляная кислота, хлороформ – ацетон, хлороформ – бензол. Общее давление над раствором (сплошные линии на рис. 3) меньше, чем вычисленные (идеальные) по закону Рауля (пунктирные линии на рис. 3).
Pi < Piо ∙ Niж
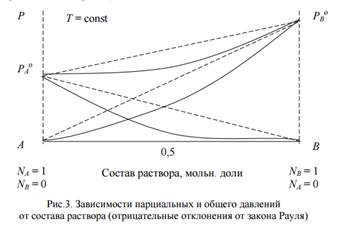
3. Предельно разбавленным называется раствор, в котором концентрация растворенного вещества бесконечно мала. Для такого раствора, давление пара растворителя подчиняется закону Рауля:
P1= P1о ∙ N1ж = P1о ∙ (1 – N2ж)
Индекс 1 соответствует растворителю. Растворяемое вещество (2) не подчиняется закону Рауля.
Растворенным обычно называют компонент, количество которого мало по сравнению с другим компонентом – растворителем.
Для растворенного вещества (индекс 2) характерен закон Генри, согласно которому: при постоянной температуре парциальное давление пар растворенного жидкого (или газообразного) вещества пропорционально его мольной доле, т.е.
P2 = К2 ∙ N2ж,
К2 – коэффициент пропорциональности, называемой константой Генри. К2 зависит от природы компонентов раствора, от температуры, но не зависит от давления (К2≠ f(P)) и является мерой растворимости газа в жидкости.
 2020-07-12
2020-07-12 464
464








