Лабораторная работа № 4
В соответствии с современными представлениями электролиты в растворах подразделяются на две группы: неассоциированные (сильные) и ассоциированные. Если электролит в растворе диссоциирован нацело, он является неассоциированным. Примером таких электролитов в разбавленных водных растворах являются хорошо растворимые в воде соли, некоторые кислоты, щелочи. Все остальные электролиты в растворе относятся к группе ассоциированных, которые делятся на три подгруппы. К первой подгруппе (слабые электролиты) относятся такие электролиты, которые в растворе находятся как в виде ионов, так и недиссоциированных молекул. Вторая подгруппа (ионные ассоциаты) - это электролиты, которые в растворах существуют как в виде простых ионов, так и ионных ассоциатов (ионных пар, тройников, квадрополей), т.е. образований, обусловленных электростатическим взаимодействием. Третья подгруппа - это комплексы различного вида (в их растворах наряду с простыми ионами имеются комплексные частицы).
Очевидно, что в зависимости от условий (концентрация раствора, его температура, свойства растворителя) один и тот же электролит может относиться к различным группам. Это принципиально важное обстоятельство позволяет строго рассчитывать количественные термодинамические характеристики электролитов.
Количественно процесс электролитической диссоциации характеризуется степенью диссоциации и константой диссоциации. Степень электролитической диссоциации равна отношению числа молекул, распавшихся на ионы n, к общему (исходному) числу растворенных молекул n.
a = n / nобщ .



Зависимость между константой диссоциации Кд ., степенью диссоциации a и концентрацией раствора С определяется уравнением:
которое представляет собой закон разбавления Освальда. В тех случаях, когда a £ 0.1, можно принять, что 1- a» 1, тогда:
Кд. = Сa2
Особенностью сильных электролитов является их полная электролитическая диссоциация в растворе, сопровождающаяся образованием гидратированных ионов и ионных пар. Последние отличаются от молекул тем, что ионы в них не соприкасаются непосредственно друг с другом, а разделены одним или несколькими слоями молекул воды, образуя с ними гидратные комплексы.
Современная теория сильных электролитов пользуется понятием «активность иона» для объяснения многообразия всех факторов, влияющих на свойства растворов сильных электролитов, таких как гидратация ионов и сила их электростатического взаимодействия, электропроводность, осмотическое давление, понижение давления пара и температуры кристаллизации, повышение температуры кипения и некоторые другие.
Активность иона - это доля ионов вещества, которая проявляет себя в действии, т.е. влияет на определенные свойства растворов сильных электролитов. Активность иона а пропорциональна концентрации иона С и для бинарных электролитов определяется выражением:
a = fC,
где С - молярная концентрация электролита; а f - коэффициент активности иона.
Если при диссоциации электролита (BaCl2, AlCl3, Na3PO4 и др.) из одной молекулы образуется n ионов какого-либо одного вида, то:
а = fCn
Активность ионов можно считать равной их концентрации лишь в сильно разбавленных растворах.

Активность ионов зависит не только от их концентрации, но также от концентрации других ионов, присутствующих в растворе. Суммарное влияние смеси различных ионов в растворе на активность каждого из них определяется с помощью ионной силы раствора m, которая зависит от концентраций и зарядов всех ионов, находящихся в растворе, и является мерой электростатического взаимодействия между ними.
Ионной силой раствора называется полусумма произведений концентраций каждого иона данного раствора на квадрат его заряда.
Коэффициент активности иона f в зависимости от m определяется по формуле Дебая-Хюккеля:

где Z - заряд иона.
Для растворов с ионной силой менее 0,01 можно пользоваться приближенной формулой:

Гидролиз солей
При растворении некоторых соединений в воде, в частности солей, наряду с процессами электролитической диссоциации с образованием гидратированных ионов протекает обменная реакция между молекулами воды и растворенного вещества. Такой процесс называется гидролизом.
Гидролиз бывает обратимым и необратимым. Положение равновесия обратимого гидролиза зависит от того, какой электролит более слабый - вода или образующееся соединение.
Вода является слабым электролитом. Равновесие реакции:
H2O Û H+ + OH- или 2Н2О Û H3O+ + OH-
характеризует ионное произведение воды
Кw,298 = [H+ ]×[OH- ] = 10-14
Ионное произведение воды - величина постоянная при постоянной температуре. С повышением температуры Kw возрастает, т.е. с повышением температуры усиливается диссоциация молекул воды.
В чистой воде при 298К [H+] = [OH-] = 10-7 моль/л. При добавлении к воде кислот или щелочей концентрация ионов Н+ и ОН- меняется, что влияет на равновесие диссоциации воды.

Концентрацию ионов водорода удобно выражать в логарифмической шкале. Отрицательный десятичный логарифм этой концентрации называют водородным показателем и обозначают рН:
Для нейтрального раствора рН =7, для кислого рН <7, для щелочного рН >7.
Изменение рН при растворении веществ в воде является одним из основных признаков, указывающих на протекание в растворе гидролиза. Характер гидролиза растворенного вещества определяется природой соли. Различают несколько вариантов гидролиза соли.
1. Соль, образованная сильным основанием и сильной кислотой практически не подвергается гидролизу, поскольку катион обладает слабо поляризующим действием, а анион не образует недиссоциированного соединения с ионами водорода. Растворы таких солей имеют нейтральную реакцию.
2. Соль, образованная сильным основанием и слабой кислотой, гидролизуется по аниону, т.к. анион образует с ионами водорода слабодиссоциирующее соединение
KCN + H2O Û KOH + HCN
CN- +H2O Û HCN + OH-
Реакция среды щелочная, рН >7.
Соли, образованные многоосновной слабой кислотой, гидролизуются ступенчато:
I. K2CO3 + H2O Û KHCO3 + KOH
CO32- + H2O Û HCO3- + OH-
II. KHCO3 + H2O Û H2CO3 + KOH
HCO3- + H2O Û H2CO3 + OH-
причем гидролиз идет в основном по первой ступени, протеканию гидролиза по второй ступени препятствуют ионы ОН-, образовавшиеся в результате гидролиза по первой ступени.
3. Соль, образованная слабым основанием и сильной кислотой, гидролизуется по катиону, т.к. катион образует с ионами гидроксила слабодиссоциирующее соединение. Взаимодействие происходит в результате сильного поляризующего действия катиона соли на молекулы воды, находящиеся в гидратной оболочке. Поскольку в результате гидролиза образуется сильная кислота, то раствор такой соли имеет рН <7. Соли многоосновных оснований гидролизуются ступенчато, причем протекает наиболее полно первая ступень гидролиза. Последняя ступень гидролиза практически не протекает:
I. Fe2(SO4)3 + 2H2O Û 2Fe(OH)SO4 + H2SO4
Fe3+ + H2O Û Fe(OH)2+ + H+
II. 2Fe(OH)SO4 + 2H2O Û [Fe(OH)2]2SO4 + H2SO4
Fe(OH)2+ + H2O Û Fe(OH)2+ + H+
При сильно поляризующем действии катиона на молекулу воды протекает гидролиз, причем усиление гидролиза происходит при уменьшении радиуса катиона и увеличении поляризующего действия иона.
Сильно поляризующее действие оказывают небольшие по размеру многозарядные ионы (Be2+, Al3+, ионы d-элементов Cu2+, Fe3+, Cr3+ и т.д.), соли которых в водных растворах в значительной степени гидролизованы. Для некоторых ионов (Be2+, Al3+, Zr4+, UO22+) наряду с образованием гидроксосолей в растворах образуются полиядерные комплексы. Некоторые соли (например, сурьмы и висмута) при растворении в воде образуют нерастворимые оксосоединения, выпадающие в осадок:
Bi(NO3)3 + H2O Û BiONO3¯ + 2HNO3
Bi3+ + H2O + NO3- Û BiONO3¯ + 2H+
Раствор становится кислым (рН <7). Согласно принципу Ле-Шателье, чтобы предотвратить гидролиз этих солей с выпадением осадков, необходимо подкислять их растворы.
4. Соль, образованная слабым основанием и слабой кислотой, гидролизуется и по катиону и по аниону.
CH3COONH4 + H2O Û CH3COOH + NH4OH
CH3COO- + NH4+ + H2O Û CH3COOH + NH4OH
рН среды зависит от силы образующихся слабых кислоты и основания, обычно рН составляет 6-8.
При смешивании двух растворов, в одном из которых соль гидролизуется по аниону, а в другом - по катиону, гидролиз протекает глубоко, если выделяется газ или осадок, или образуется газ и осадок одновременно:
2CrCl3 + 3Na2CO3 + 3H2O ® 2Cr(OH)3¯ + 3CO2 + 6NaCl
2Cr3+ + 3CO32- + 3H2O ® 2Cr(OH)3¯ + 3CO2
К реакциям гидролиза относятся также процессы взаимодействия с водой галогенангидридов:
AsCl3 + 3H2O Û H3AsO3 + 3HCl
PCl5 + 4H2O Û H3PO4 + 5HCl
Количественной оценкой гидролиза является степень h и константа Kг. гидролиза. Степень гидролиза тем больше: чем больше Кw, т.е. чем больше температура (так как Кw возрастает с температурой); чем меньше Ккисл. или Косн., т.е. чем слабее кислота или основание, которые образуются в результате гидролиза соли; чем меньше концентрация, т.е. чем больше разбавлен раствор.
Константой гидролиза называется отношение произведения концентраций продуктов гидролиза к концентрации негидролизованной соли. Для реакции:
CN- + H2O Û HCN + OH-
константа гидролиза запишется в виде:
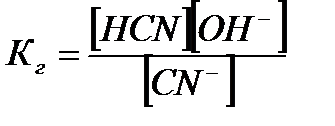
 Величина Кг., в отличие от степени гидролиза, не зависит от концентрации раствора, поэтому является более удобной характеристикой процесса. Обе величины связаны между собой соотношением:
Величина Кг., в отличие от степени гидролиза, не зависит от концентрации раствора, поэтому является более удобной характеристикой процесса. Обе величины связаны между собой соотношением:

При малых значениях h: 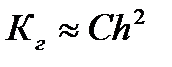 ,
,
откуда: 
Буферные растворы
Буферные растворы - растворы, поддерживающие определенную концентрацию ионов водорода (рН) при разбавлении и незначительно изменяющие ее при добавлении небольших количеств сильных кислот и оснований.
Буферные растворы содержат либо слабую кислоту и ее соль, образованную сильным основанием, либо слабое основание и его соль, образованную сильной кислотой. Буферными свойствами обладают также растворы, содержащие смеси солей многоосновных кислот. Добавление больших количеств сильной кислоты или щелочи приводит к потере буферных свойств раствора. Количество вещества эквивалента сильной кислоты или щелочи, необходимое для смещения рН 1л буферного раствора на одну единицу, называется буферной емкостью. Буферная емкость раствора тем выше, чем больше концентрация компонентов и чем меньше эти концентрации различаются между собой. Буферное действие практически прекращается, когда один из компонентов раствора израсходуется примерно на 90%. Разбавление раствора не влияет заметно на изменение рН, но сильно влияет на буферную емкость. Каждый буферный раствор имеет определенное значение рН.
Гетерогенные равновесия
В насыщенном растворе малорастворимого электролита, например CaCO3, находящегося в соприкосновении с твердой фазой, непрерывно протекают два противоположно направленных процесса. С одной стороны, полярные молекулы воды ориентируются определенным образом относительно ионов Ca2+ и CO32-, входящих в состав кристаллической решетки CaCO3, а выделяющаяся при этом энергия гидратации способствует их отрыву от кристалла и переходу в раствор в виде гидратированных ионов. С другой стороны, гидратированные ионы Ca2+ и CO32-, сталкиваясь при движении с твердой фазой, испытывают притяжение со стороны противоположно заряженных ионов, лежащих на ее поверхности, и, освобождаясь от гидратной оболочки, вновь занимают свои места в кристаллической решетке CaCO3. Когда оба процесса протекают с одинаковой скоростью, в системе устанавливается равновесие:
CaCO3 Û Ca2+ + CO32-
Переход ионов в раствор и обратный процесс - внедрение ионов в кристаллическую решетку твердого вещества - происходят лишь на его поверхности, которая при данной степени измельчения является постоянной величиной. В таком случае, на основании закона действия масс, состояние равновесия зависит только от произведения концентрации ионов, которое для данного малорастворимого электролита является величиной постоянной.
Произведение концентраций ионов (а более точно, активностей ионов) в насыщенном растворе малорастворимого электролита, находящегося в равновесии с осадком, есть постоянная при данной температуре величина, которая называется произведением растворимости и обозначается ПР.
Для карбоната кальция эта величина определяется выражением
ПР = [Ca2+][CO32-]
Зная ПР малорастворимого электролита, можно вычислить его растворимость в молях на литр и в граммах на литр. Выведем уравнение, позволяющее рассчитывать растворимость по известному числовому значению ПР. Для этого концентрации катиона и аниона выразим через растворимость S электролита KnAm:
[Km+] = nS
[An-] = mS
Отсюда ПР = (nS)n(mS)m = nnmmS(n+m)

Cледовательно, растворимость для вещества KnAm
В приведенном методе расчета растворимости малорастворимых электролитов не принимаются во внимание гидролиз и комплексообразование, в результате которых растворимость может возрастать.
Из понятия ПР вытекает условие образования осадков: малорастворимый электролит всегда выпадает в осадок, когда произведение концентрации ионов сделается больше величины ПР электролита, т.е. в случае CaCO3, когда [Ca2+][CO32-]>> ПР. Это будет достигнуто прибавлением избытка электролита, содержащего Ca2+ или CO32- ионы. Растворение осадка происходит тогда, когда произведение концентраций ионов сделается меньше величины ПР электролита, т.е. в случае CaCO3, когда [Ca2+][CO32-]<< ПР. Этого можно достигнуть, связывая один из ионов, посылаемых осадком в раствор. Это осуществляется образованием:
· малодиссоциированного соединения;
· комплексного иона;
· менее растворимого соединения;
· изменением заряда иона в окислительно-восстановительной реакции.
Экспериментальная часть
 2020-07-12
2020-07-12 177
177







