ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ПРОЦЕССЫ
Степень окисления. Окислители и восстановители
Окислительно-восстановительными называются реакции, сопровождающиеся изменением степеней окисления атомов, входящих в состав реагирующих веществ. Степень окисления — это условный заряд атома в соединении, вычисленный из предположения, что все связи в соединении являются чисто ионными, а само соединение состоит из ионов.
Поскольку чисто ионных связей не существует, действительные (эффективные) заряды атомов в соединениях часто сильно отличаются по числовым значениям от степеней окисления. Однако понятие «степень окисления» очень полезно для классификации веществ и нахождения стехиометрических коэффициентов уравнений химических реакций.
Если в результате реакции степень окисления атома увеличивается, то говорят, что он окисляется. Примерами окисления служат процессы:
Fe2+ - 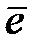 ® Fe3+
® Fe3+
2I- - 2 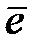 ® I2
® I2
Mn2+ +4H2O - 5 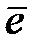 ® MnO4- + 8H+
® MnO4- + 8H+
Из них видно, что окисление связано с отщеплением — потерей — электронов.
Если же в результате реакции степень окисления атома уменьшается, то говорят, что он восстанавливается.
В качестве примеров восстановления могут служить процессы, обратные записанным выше:
Fe3+ + 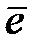 ® Fe2+
® Fe2+
I2 + 2 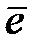 ® 2I-
® 2I-
MnO4- + 8H+ + 5 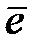 ® Mn2+ +4H2O
® Mn2+ +4H2O
Из них видно, что восстановление связано с присоединением электронов восстанавливающимся атомом.
Окисление — это отдача электронов, восстановление — присоединение электронов.
Атом, молекула или ион, принимающие электроны, называются окислителями. Атом, молекула или ион, отдающие электроны, называются восстановителями.
Понятие «окислитель» и «восстановитель» часто используют как совершенно однозначные характеристики окислительно-восстановительных свойств соединений. В действительности эти понятия относительны.
Так, например, молекулярный водород в огромном числе реакций используется как восстановитель. К числу таких реакций относятся:
CuO + H2 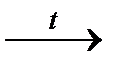 Cu + H2O
Cu + H2O
CH3COН + H2 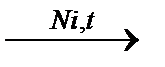 CH3CH2OH
CH3CH2OH
Но в реакциях образования гидридов щелочных и щелочноземельных металлов тот же водород играет роль окислителя:
2Na + H2 ® 2NaH
Целесообразно запомнить важнейшие окислители и восстановители. К важнейшим окислителям относятся:
1) свободные неметаллы (галогены, кислород, сера), которые в результате реакций превращаются в одноатомные анионы;
2) кислородсодержащие ионы и молекулы, в которых центральный атом имеет высшую или высокую степень окисления (MnO4-, Cr2O72-, CrO42-, NO3-, ClO3-);
3) одноатомные катионы, в которых элементы проявляют свою высшую степень окисления (Ce4+, Fe3+, Ag+, H+).
Важнейшими восстановителями являются:
1. свободные металлы, а из неметаллов – углерод и водород;
2. многоатомные ионы и молекулы, в которых центральный атом имеет низшую или низкую степень окисления (H2S, NH3, SO32-, NO2-, CrO2-);
3. одноатомные ионы, в которых элементы проявляют низшую или низкую степень окисления (I-, S2-, Sn2+, Fe2+).
Таким образом, вещества, содержащие атомы в высших степенях окисления, могут быть только окислителями, т.е. только принимать электроны. Вещества, содержащие атомы в низших степенях окисления, могут быть только восстановителями, т.е. только отдавать электроны. Вещества, содержащие атомы в промежуточных степенях окисления, могут быть как окислителями, так и восстановителями.
Составление уравнений окислительно-восстановительных реакций
Для реакций, не связанных с изменением степеней окисления элементов, характерны небольшие стехиометрические коэффициенты, нахождение которых обычно не вызывает трудностей. Напротив, реакции окисления-восстановления часто имеют сложную стехиометрию. Примером может служить окисление минерала пирита FeS2 кислородом:
4FeS2 + 11O2 = 2Fe2O3 + 8 SO2
Поэтому нахождение стехиометрических коэффициентов реакций окисления-восстановления часто оказывается непростой задачей, которую решают с применением специально разработанных приемов. Рассмотрим метод полуреакций, обычно применяемый к реакциям в водных растворах.
Ключевая задача этого метода — составление уравнений полуреакций. При использовании этого метода каждая окислительно-восстановительная реакция представляется как алгебраическая сумма двух полуреакций: полуреакции восстановления окислителя и полуреакции окисления восстановителя. Составляя уравнения полуреакций, используют те же правила, что и при составлении обычных ионных реакций в растворах: для неэлектролитов и слабых электролитов записывают формулы их молекул, а для сильных электролитов — формулы только тех ионов, в состав которых входят атомы элементов, изменяющих в результате реакции степени окисления. От обычных ионных уравнений уравнения полуреакций отличаются наличием в них символов электронов.
Уравнения многих полуреакций очень просты. В них присутствуют всего три вида частиц: электроны и две формы соединений одного и того же элемента:
Cu2+ + 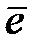 Û Cu+
Û Cu+
Br2 + 2 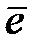 Û 2Br-
Û 2Br-
MnO4- + 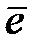 Û MnO42-
Û MnO42-
Одна из них — окисленная форма — содержит атомы элемента в более высокой степени окисления. В приведенных примерах окисленными формами являются Си2+, Вг2 и MnO4-. Другая — восстановленная форма — содержит атомы этого же элемента в более низкой степени окисления. В приведенных примерах восстановленные формы — это Си+, Вг- и MnO42-.
Немного сложнее уравнения полуреакции типа:
PbSO4 + 2 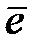 Û Pb + SO42-
Û Pb + SO42-
[Cu(NH3)4]2+ + 2 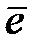 Û Cu + 4NH3
Û Cu + 4NH3
В этих полуреакциях наряду с атомами элементов, изменяющих степени окисления, присутствуют сульфат-ионы SO42- и молекулы NH3, все атомы которых сохраняют постоянные степени окисления, а сами эти ионы и молекулы имеют одинаковый состав в левой и правой частях уравнения.
Сложнее других полуреакции с участием кислородсодержащих анионов (оксоанионов) типа NO3-, MnO4-, Cr2O72-. В результате восстановления оксоанионы могут терять все входящие в их состав атомы кислорода или часть этих атомов. Например, перманганат-ион в результате восстановления в кислой среде превращается в катион Mn2+, теряя четыре атома кислорода. При восстановлении перманганат-иона в нейтральной и слабощелочной среде образуется оксид марганца (IV) MnO2, в ходе этой реакции MnO4- отдает два атома кислорода.
Составляя полуреакции восстановления оксоанионов, принимают, что атомы кислорода в оксоанионах имеют формальную степень окисления -2, хотя даже в ионных кристаллах оксидов щелочных и щелочноземельных металлов действительный заряд оксид-анионов O2- не достигает этого значения. В соответствии со степенью окисления -2 предполагают, что атомы кислорода, отщепляющиеся от оксоанионов, реагируют с водой так же, как оксид-анионы, попадающие в раствор при разрушении кристаллических решеток ионных оксидов:
Na2O + H2O ® 2Na+ + 2OH-
т.е. предполагают, что при взаимодействии одного иона O2-с молекулой воды образуются два иона ОН-:
O2- + H2O ® 2OH-
В соответствии с этим предположением полуреакцию восстановления перманганат-иона в нейтральной среде можно записать так:
MnO4- + 2H2O + 3 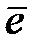 Û MnO2 + 4OH-
Û MnO2 + 4OH-
При разрушении оксоанионов в кислой среде, где имеется избыток катионов Н+, образуются не гидроксид-ионы, а молекулы воды:
MnO4- + 8Н+ + 5 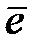 Û Mn2+ + 4 H2O
Û Mn2+ + 4 H2O
Для связывания одного атома кислорода в степени окисления -2 при этом расходуются два катиона Н+.
Полуреакции, составленные с использованием описанных приемов, приведены в справочниках, где они записаны как полуреакции восстановления, т.е. в левой части уравнения — окисленная форма, а в правой — восстановленная. Это сделано для того, чтобы не повторять в таблицах одну полуреакцию дважды, сначала как полуреакцию окисления, а затем как полуреакцию восстановления.
Как же, используя полуреакции, составить уравнение реакции окисления — восстановления? Рассмотрим процесс составления уравнения на примере реакции между перманганатом калия КMnO4 и сульфитом натрия Na2SO3 в присутствии H2SO4.
Прежде чем приступить к составлению уравнений, следует определить, какую роль играют каждая молекула и ион в данной реакции, т.е. назвать окислитель и восстановитель, а также те молекулы и ионы, атомы которых не изменяют степеней окисления. Если хотя бы одно из веществ, участвующих в реакции, содержит атом в высшей или низшей возможной для данного элемента степени окисления, то предсказать роль этого вещества можно, пользуясь перечнем, приведенным выше. Если оба вещества, участвующих в реакции, содержат атомы в промежуточных степенях окисления, то определить, какое из веществ будет окислителем, а какое — восстановителем, можно с помощью стандартных окислительно-восстановительных потенциалов.
В рассматриваемом примере перманганат калия содержит марганец в высшей степени окисления +7, и поэтому он может играть только роль окислителя. Сульфит натрия содержит серу в промежуточной степени окисления +4 и может быть и окислителем, и восстановителем. В данном случае в присутствии сильного окислителя — перманганата калия — сульфит натрия является восстановителем. Разбавленная серная кислота окислительно-восстановительными свойствами не обладает. Она играет роль источника ионов водорода, т. е. обеспечивает кислую реакцию среды.
После этого следует составить или найти в справочнике нужные уравнения полуреакций, а затем получить их алгебраическую сумму. Для этого обе полуреакции нужно записать одну под другой. Причем ту полуреакцию, которая описывает восстановление окислителя, следует привести в табличной форме, а вторую полуреакцию нужно преобразовать: перенести все члены уравнения из левой части в правую и наоборот так, чтобы она превратилась в полуреакцию окисления восстановителя. Перед сложением надо все члены уравнения первой полуреакции умножить на число электронов, отдаваемых восстановителем во второй полуреакции, а все члены второй полуреакции следует умножить на число электронов, присоединяемых окислителем в первой полуреакции. После этого все члены левых и правых частей уравнения полуреакций суммируются. Таким образом, получается уравнение реакции окисления — восстановления в сокращенной ионной форме.
Для рассматриваемой реакции окисления сульфита натрия перманганатом калия в кислой среде уравнение полуреакции восстановления MnO4- и уравнение полуреакции окисления SO32- запишутся следующим образом:
MnO4- + 8H+ + 5 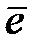 Û Mn2+ + 4H2O ½ 2 (восстановление)
Û Mn2+ + 4H2O ½ 2 (восстановление)
SO32- + H2O - 2 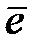 Û SO42- + 2H+ ½ 5 (окисление)
Û SO42- + 2H+ ½ 5 (окисление)
2MnO4- + 16H+ + 5SO32- + 5H2O Û 2Mn2+ + 8H2O + 5SO42- +10H+
Справа от вертикальной черты записываем множители — числа электронов. После приведения однородных членов уравнения (катионы H+, молекулы H2O) получаем сокращенное ионное уравнение реакции окисления сульфита натрия перманганатом калия в кислой среде:
2MnO4- + 6H+ + 5SO32- Û 2Mn2+ + 3H2O + 5SO42-
Для получения молекулярной формы уравнения каждому иону добавляем определенное число противоионов, необходимое для полной нейтрализации заряда иона. Объединяя ионы в формулы молекул, получаем уравнение в молекулярной форме:
2KMnO4+5Na2SO3+3H2SO4Û 2MnSO4+3H2O+5Na2SO42-+K2SO4
Экспериментальная часть
 2020-07-12
2020-07-12 390
390








