Молекулярно-кинетическая теория – учение, которое объясняет строение и свойства веществ движением частиц, из которых состоят вещества, и взаимодействием этих частиц между собой. Это учение базируется на следующих основных положениях:
а) все вещества состоят из частиц – атомов, молекул и др.;
б) частицы, из которых состоит вещество, находятся в непрерывном хаотическом движении, называемом тепловым;
в) частицы вещества взаимодействуют между собой с помощью сил притяжения и отталкивания одновременно.
Основное уравнение кинетической теории газов.

p – давление молекул газа на границы емкости,
m0 – масса одной молекулы,
n - концентрация молекул, число частиц N в единице объема V,
v2 - средне квадратичная скорость движения молекул.
Идеальный газ. Уравнение состояния идеального газа.
Идеальным называется газ, при рассмотрении которого не учитывается взаимодействие между его молекулами. При соударении друг с другом и со стенками сосуда молекулы такого газа принимаются за абсолютно упругие шарики предельно малых размеров.
Состояние идеального газа описывается уравнением Менделеева – Клапейрона:
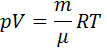
где m – масса газа; m – молярная масса; R = 8,31 Дж / (моль * К) – универсальная газовая постоянная.
 2020-07-12
2020-07-12 92
92








