СЛАЙД 40. В соответствии с законами термодинамики состояние термодинамической системы может быть равновесным и неравновесным. Равновесным называют такое состояние системы, при котором во всех точках ее объема параметры состояния и физические свойства (давление, температура, удельный объем и др.) одинаковы, иными словами, система находится в термодинамическом равновесии, если при изоляции ее от воздействия внешней среды параметры состояния системы не изменяются.
Термодинамический процесс совершается, когда в рабочем теле или системе изменяется хотя бы один из основных параметров состояния. Если рабочее тело или система проходит ряд равновесных состояний, процесс называется равновесным термодинамическим процессом. Процессы бывают обратимыми и необратимыми. Обратимый процесс — равновесный термодинамический процесс, который может проходить как в прямом, так и в обратном направлении, проходя через одинаковые промежуточные состояния, причем система возвращается в исходное состояние без затрат энергии, и в окружающей среде не остается макроскопических изменений. Невыполнение этого условия делает процесс необратимым.
Простая гомогенная система в равновесном состоянии характеризуется определёнными значениями параметров состояния 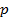 ,
,  и
и 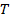 . Между ними существует зависимость, которая называется термическим уравнением (3):
. Между ними существует зависимость, которая называется термическим уравнением (3):
 . (3)
. (3)
Состояние однородного рабочего тела однозначно определено, если известны два основных параметра, так как любой третий параметр является для каждого равновесного состояния функцией двух других (4):
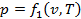 ,
, 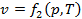 ,
, 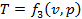 (4)
(4)
Термическое уравнение состояния газов при малых давлениях принимает простое выражение. Если по измеренным значениям  ,
,  и
и  рассчитать величину
рассчитать величину  , то можно определить константу
, то можно определить константу  , называемую газовой постоянной (5):
, называемую газовой постоянной (5):
 (5)
(5)
Газовая постоянная представляет работу, которую совершает 1 кг газа при постоянном давлении и при изменении температуры на 1 градус.
Используя понятие газовой постоянной, уравнение состояния можно записать в виде (6)
 . (6)
. (6)
Газ, состояние которого точно описывается уравнением (6), называется идеальным, а само уравнение - термическим уравнением состояния идеальных газов, или уравнением Клапейрона. Умножая обе части уравнения (6) на молекулярную массу μ, получим (7):
 , (7)
, (7)
где  - объем, занимаемый одним молем газа. Молем или киломолем называется количество газа, масса которого в килограммах численно равна его молекулярной массе.
- объем, занимаемый одним молем газа. Молем или киломолем называется количество газа, масса которого в килограммах численно равна его молекулярной массе.
Произведение 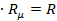 называется универсальной газовой постоянной. Она имеет для каждого газа своё значение и может быть вычислена из уравнения (для 1 кмоль газ) (8):
называется универсальной газовой постоянной. Она имеет для каждого газа своё значение и может быть вычислена из уравнения (для 1 кмоль газ) (8):
 Дж/(кмоль⋅К) (8)
Дж/(кмоль⋅К) (8)
Для конкретного газа величина газовой постоянной определяется по формуле (9):
 (9)
(9)
Табличные значения газовых постоянных и молекулярных масс представлены в таблице 1.1
Таблиц 1.1 Значения газовых и молекулярных масс газов.
| Газы | |||||
| Параметры | О2 | N2 | CO2 | Пары Н2О | сухой воздух |
| Молекулярный вес | 32 | 28,016 | 44,01 | 18,02 | |
| Универсальная газовая постоянная, кДж/(кмоль*К) | 259,82 | 296,77 | 188,92 | 461,51 | 287,05 |
Изменение параметров состояния подчиняется следующим законам.
СЛАЙД 41. Закон Авогадро. В одинаковых объемах любого идеального газа при одинаковых температуре и давлении содержится одно и то же количество молекул. Установлено, что при нормальных условиях 1 кмоль любого вещества в газообразном состоянии занимает объем 22,4 м3 или, что то же самое, 1 моль – 22,4 дм3 (округленно) и содержит 6,023·1023 молекул. Эти величины носят название: 22,4 – мольный объем, 6,023·1023 – число Авогадро. Отсюда вытекает, что, зная молекулярную массу μ газа, можно вычислить его плотность ρ0, выраженную в килограммах на квадратный метр при нормальных условиях (0 °С и давлении 101,325 кН / м2) ρ0= μ / 22,4 кг/м3.
Закон Бойля-Мариотта - выражает зависимость между объемом и давлением
При постоянной температуре объем (V) данного количества газа обратно пропорционален давлению ( 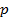 ),
),  , или, что то же
, или, что то же
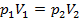 ;
;  .
.
Закон Гей-Люссака - выражает зависимость между объемом и температурой идеального газа при постоянном давлении, а также между температурой и давлением этого газа при постоянном объеме.
Объемы, занимаемые данной массой газа, при постоянном давлении относятся как их абсолютные температуры (10)
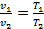 . (10)
. (10)
При постоянном объема газа закон Гей-Люссака приобретает следующую формулировку: давления данной массы газа при постоянном объеме пропорциональны абсолютной температуре этого газа (11)
 . (11)
. (11)
СЛАЙД 42. Решая совместно уравнения (10) и (11), получим (12)
 . (12)
. (12)
где p должно быть выражено в ньютонах на метр, а 2,68⋅10-3 имеет размерность (Н/м2 град).
Математическое обобщение законов Бойля и Гей-Люссака приводит к уравнению, связывающему объем газа с его температурой и давлением (уравнение Менделеева-Клапейрона) и характеризующему полное состояние газа (13):
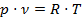 (13)
(13)
Газы, строго подчиняющиеся уравнению (13), называются идеальными, а само уравнение термическим уравнением состояния идеальных газов. Если уравнение (13) умножить на массу М, то получим уравнение состояния для m кг газа (14):
 или
или  (14)
(14)
Все эти уравнения носят название характеристических (термических) уравнений состояния газа, отражают равновесное состояние газа при конкретных p 1 v 1 T 1.
 2020-08-05
2020-08-05 164
164








