СЛАЙД 39. Знание и понимание законов термодинамики влажного воздуха является основой успешного исследования взаимодействия организма с окружающей средой. Поэтому мы кратко затронем основные законы термодинамики идеальных газов и смесей.
Основные положения
Макроскопические тела, между которыми происходит обмен энергией в форме теплоты или работы принято называть рабочими телами. Термодинамическая система - совокупность рабочих тел, обменивающихся между собой энергией или веществом. В качестве рабочих тел в технической термодинамике рассматривают газы и пары. Система отделяется от внешней среды материальной или воображаемой поверхностью - границей системы.
В зависимости от условий взаимодействия термодинамической системы с другими рассматривают открытую и закрытую, неизолированную или изолированную и адиабатную системы. В открытой системе происходит обмен веществом с другой системой. Граница закрытой системы непроницаема для вещества, поэтому в ней содержится одно и то же количество вещества, однако объём, замкнутый границей, может меняться, если границы системы подвижны. Система называется неизолированной, если она допускает обмен с внешней средой и теплотой, и работой. В изолированной системе нет обмена ни веществом, ни энергией. Адиабатной системой называется система, которая не может обмениваться энергией с окружающей средой путем теплообмена с другими системами, но они могут быть как открытыми, так и закрытыми.
Если состав смеси газов одинаков во всей системе, и они не вступают друг с другом в химические реакции, то система является гомогенной. Гомогенная система состоит из одной фазы, а гетерогенная система из двух или более фаз. Примером гомогенной системы является воздух, состоящий из смеси различных газов и водяного пара, а гетерогенной системы - туман, когда наряду с газовой фазой в системе присутствует жидкая (капли воды) или твёрдая (кристаллы льда) фаза.
Установление границ между системой и её внешней средой является необходимым, но недостаточным элементом описания системы. Система должна описываться рядом переменных, т. е. физических величин, характеризующих её свойства. Если системой является определённое количество газа, то для описания свойств этой системы задаётся несколько макроскопических переменных, например, объём и давление. Если переменные принимают устойчивые значения, то система находится в определённом состоянии и переменные, характеризующие устойчивое состояние системы, называются термодинамическими параметрами состояния. К ним относятся основные параметры: температура T, давление p, удельный объём v, и расчетные параметры: внутренняя энергия, энтальпия, энтропия.
Внутренние параметры характеризуют внутреннее состояние системы, к ним относятся давление, температура, объем и др.
Внешние параметры определяют положение системы (ее координаты) во внешних силовых полях и ее скорость.
Внутренние параметры подразделяются на интенсивные и экстенсивные. Экстенсивными называются параметрами состояния, значения которых определяются суммой параметров состояния составляющих частей условно разделённой системы. Экстенсивные параметры состояния, определяют размер рассматриваемой системы, например, объём и масса. Если рассматривается гомогенная система, то при разделении её на части объём делится пропорционально массе. Это справедливо не только для объёма, но и для всех других экстенсивных величин. Особенно удобна для этих целей масса вещества.
Параметры состояния, значения которых остаются одинаковыми во всех частях гомогенной системы, называются интенсивными параметрами состояния. Они не зависят от размеров системы. Для характеристики конкретных условий, в которых находится данная система, или процесса, идущего в системе, обычно необходимо знать такие интенсивные параметры состояния, как удельный объем, давление, абсолютная температура и другие.
Во многих термодинамических исследованиях масса вещества не имеет значения, а интерес представляет только интенсивное состояние. При этом вместо экстенсивных используют удельные параметры состояния, которые ведут себя как интенсивные параметры: при разделении системы они остаются постоянными.
В общем случае любой экстенсивный параметр состояния Е, делённый на массу m, становится соответствующим удельным параметром состояния
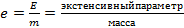 .
.
Поэтому интенсивное состояние системы можно описывать также удельными параметрами состояния. К таким параметрам можно отнести удельный объём v - объем, занимаемый 1 кг газа (для каждой температуры свой), м3/кг (1):
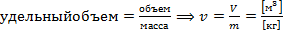 , (1)
, (1)
а плотность газа определяется по формуле (2):
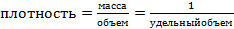
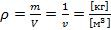 (2)
(2)
где V- объем, м3, m – масса, кг.
Давление - отношение нормальной составляющей силы, действующей на заданную поверхность, к площади этой поверхности (средний результат ударов молекул газа о стенки сосуда, в котором он находится обозначается
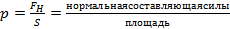 ,
,
где F н - нормальная составляющая силы, Н.
Единицы измерения: 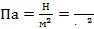 .
.
Единицы перевода: 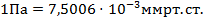
 2020-08-05
2020-08-05 105
105








