Теория кристаллического поля основывается на допущении, что связь между комплексообразователем и лигандами частично ионная. Однако принимается во внимание влияние электростатического поля лигандов на энергетическое состояние электронов центрального иона.
Рассмотрим две комплексные соли: K2[Zn(CN)4] и K3[Fe(CN)6].
K2[Zn(CN)4] – имеет тетраэдрическую пространственную структуру (sp3— гибридизация)
K3[Fe(CN)6] – имеет октаэдрическую пространственную структуру (sp3d2-гибридизация)
Комплексообразователи имеют следующую электронную конфигурацию:
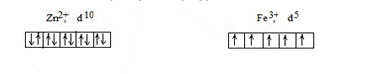
d – электроны одного и того же энергетического уровня одинаковы в случае свободного атома или иона. Но действие электростатического поля лигандов способствует расщеплению энергетических уровней d – орбиталей в центральном ионе. И расщепление тем больше (при одном и том же комплексообразователе), чем сильнее поле, создаваемое лигандами. По своей способности вызывать расщепление энергетических уровней лиганды располагаются в ряд:
CN— > NO2— > NH3 > SCN— > H2O > OH— > F— > Cl— > Br— > I—
Строение комплексного иона влияет на характер расщепления энергетических уровней комплексообразователя.
Энергию расщепления Δ определяют экспериментально по спектрам поглощения веществом квантов света, энергия которых равна энергии соответствующих электронных переходов. Спектр поглощения, а также и окраска комплексных соединений d-элементов, обусловлены переходом электронов с d-орбитали низшей энергии на d-орбиталь с более высокой энергией.
12)
13) Соединения железа в с.о. +2, +3: оксиды, гидроксиды, соли, роль соединений в ОВ - реакциях. Качественные реакции на ионы железа.
1)FeO – оксид железа(II), черный; Fe(OH)2 — гидроксид железа(II), белый; проявляют основные свойства;
2) Fe2О3 — оксид железа(III), красно-бурый; Fe(OH)3 – гидроксид железа(III), бурый; проявляют амфотерные свойства.
1. Растворимые соли ионов железа Fe(2+) и Fe(3+) реагируют с растворами щелочей при комнатной температуре:
FeSO4 +2NaOH = Fe(OH)2 + Na2SO4 белый, зеленеет
FeCl3 + 3NaOH = Fe(OH)3 + 3NaCL бурый
2. Гидроксид и оксид железа(II) вступают в реакцию с кислотами:
Fe(OH)2 + 2HC1 = FeCl2 + 2H2O, FeO + H2SO4 = FeSO4 + H2O
Гидроксид железа(III) амфотерен, т.е. вступает в реакции с кислотами и концентрированными растворами щелочей:
Fe(OH)3 + 3HCl = FeCl3 +3H2O, Fe(OH)3 + 3NaOH = Na3[Fe(OH)6].
Оксид железа(III) реагирует с кислотами и с основными оксидами:
Fe2O3 + 6HСl = 2FeCl3 + 3H2O
3. Гидроксиды железа(ІІ) и (ІІІ) разлагаются при нагревании:
Fe(OH)2 = FeO+H2O 2Fe(OH)3 = Fe2O3+3H2O
4. Катионы железа(II) легко окисляются кислородом воздуха или другими окислителями до катионов железа(III). Поэтому белый осадок гидроксида железа(II) на воздухе сначала приобретает зеленую окраску, а затем становится бурым, превращаясь в гидроксид железа(III):
4Fe(OH)2+2 H2O+O2 = 4 Fe(OH)3
1)4FeCl3 + 3K4[Fe(CN)6] = Fe4[Fe(CN)6]3+ 12KCl.
Это качественная реакция нa ионы Fe(3+)
2) 3FeSO4 + 2K3[Fe(CN)6] = Fe3[Fe(CN)6]2+ 3K2SO4.
Это качественная реакция на ионы Fe(2+)
Получение:
FeSO4 + 2KOH → Fe(OH)2 (осадок) + K2SO4
2) Осаждение из раствора солей железа(III) гидрата Fe2O3 · nH2O и его частичное обезвоживание.
В природе — оксидная руда железа лимонит Fe2O3 · nH2O и минерал гётит FeO(OH).
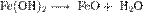
14. Соединения кобальта в с.о. +2, +3: оксиды, гидроксиды, соли, роль соединений в ОВ-реакциях.
Основание Со(ОН)2 — слабое, трудно окисляется кислородом воздуха:
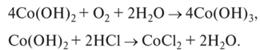
Соединения Со203 и Со(ОН)3 — сильные окислители:
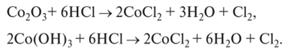
Кобальт образует большое количество комплексных соединений. Наиболее устойчивы комплексные соединения кобальта (III).
Оксиды обладают слабовыраженными амфотерными свойствами с преобладанием основных. Практически не растворяются в воде, реагируют с кислотами с образованием солей, например:
CoO + 2HCl = CoCl2 + H2O.
Растворяются в расплавах щелочей, а при доступе воздуха – в водном растворе аммиака:
CoO + Ba(OH)2 = BaCoO2 + H2O.
Гидроксиды практически не растворимы в воде, проявляют в основном основные свойства. Реагируют с кислотами, например:
Co(OH)2 + 2HCl = CoCl2 + 2H2O.
Растворяются в водных растворах аммиака с образованием аммиачных комплексов, например:
Co(OH)2 + 6NH3 = [Co(NH3)6](OH)2.
Гидроксид кобальта растворяется в концентрированных растворах щелочей с образованием гексагидроксокобальтата (II) натрия, что свидетельствует о проявлении слабовыраженных кислотных свойств:
Co(OH)2 + 4NaOH = Na4[Co(OH)6].
При нагревании гидроксиды разлагаются, например:
Co(OH)2 = CoO + H2O.
Аналогично гидроксиду железа (II), гидроксид кобальта (II) медленно окисляется кислородом воздуха:
4Сo(OH)2 + O2 + 2H2O = 4Co(OH)3.
Кобальт (II) образует соли практически со всеми анионами. Обычно соли кристаллизуются в виде розовых или красных кристаллогидратов: Co(NO3)2·6H2O, CoSO4·7H2O, CoCl2·6H2O и др. Растворы солей имеют ярко-розовую окраску, характерную для аквакомплексов кобальта (II).
15. Соединения никеля в с.о. +2, +3: оксиды, гидроксиды, соли, роль соединений в ОВ- реакциях.
Оксиды обладают слабовыраженными амфотерными свойствами с преобладанием основных. Практически не растворяются в воде, реагируют с кислотами с образованием солей, например:
NiO+ 2HCl = NiCl2 + H2O.
Растворяются в расплавах щелочей, а при доступе воздуха – в водном растворе аммиака:
NiO + Ba(OH)2 = BaNiO2 + H2O.
Гидроксиды практически не растворимы в воде, проявляют в основном основные свойства. Реагируют с кислотами, например:
Ni(OH)2 + 2HCl = NiCl2 + 2H2O.
Растворяются в водных растворах аммиака с образованием аммиачных комплексов, например:
Ni(OH)2 + 6NH3 = [Ni(NH3)6](OH)2.
При нагревании гидроксиды разлагаются, например:
Ni(OH)2 = NiO + H2O.
Гидроксид никеля (II) на воздухе устойчив.
Никель (II) также образует большое количество солей. Обычно соли кристаллизуются в виде зеленых кристаллогидратов (различных оттенков): Ni(NO3)2·6H2O, NiSO4·6H2O, Fe(ClO4)2·6H2O, K2Ni(SO4)2·6H2O и др. Растворы солей имеют ярко-зеленую окраску, характерную для аквакомплексов никеля (II).
16. Соединения марганца в с.о. +2: оксид, гидроксид, соли, роль соединений в ОВ- реакциях, зависимость глубины окисления от силы окислителя и реакции среды.
Mn образует основной оксид переменного состава – MnO - MnO1,5, гидроксид - Mn(OH)2
Оксид Mn (II) образуется при прокаливании карбоната марганца в атмосфере азота или водорода:
MnСО3 = MnO +СО2.
Так как гидроксид марганца нерастворим в воде, его получают косвенным путем:
Mn2++ 2OH¯= Mn(OH)2
Он легко растворяется в кислотах, со щелочами реагирует только при сильном и длительном нагревании:
Mn(OH)2+ 2H+ = Mn2+ + 2H2O
Mn(OH)2 + 4OH ¯(конц.) = [Mn (ОН)6] 4 –
Гидроксид в степени окисления +2 неустойчив и окисляется на воздухе, значительно легче идет окисление галогенами:
Mn(ОН)2 + Br2 + 2NaOH→ MnO2 + 2 NaBr +2H2O
В зависимости от силы окислителя и рН среды ион Mn2+ может окисляться до степеней окисления +4, +6 и +7:
3MnSO4 + 2KMnO4 +3H2O = 5MnO2↓ + K2SO4 + 3H2SO4
3MnSO4 + 2KС1O3 + 12KOH сплав 3K2MnO4 +3K2SO4 + 2KCI + 6H2O
2Mn(NO3)2 + 5NaBiO3 + 16HNO3 → 2HMnO4+ 5Bi(NO3)3+ 5NaNO3 + 7H2O
Последняя реакция используется в аналитической химии как качественная реакция на соединения марганца.
Из комплексных соединений Mn2+ устойчивы только цианиды, остальные манганаты (II) в разбавленных водных растворах распадаются.
17. Соединения марганца в c.о. +4: роль соединений в ОВ- реакциях, зависимость глубины окисления от силы окислителя и реакции среды.
Наиболее устойчивым соединением марганца в степени окисления +4 является MnO2-черно-бурое твердое вещество, обычно переменного состава, оно широко распространено в земной коре. Кристаллы MnО2 построены по типу кристаллов рутила. При обычных температурах MnО2 в воде не растворяется и довольно инертен - без нагревания устойчив к действию большинства кислот. По химической природе оксид марганца (IV) – амфотерен. При сплавлении со щелочами или основными оксидами образуются оксоманганаты (IV):
MnО2 + СаО = Са MnО4.
Соединения Mn(IV) сильные окислители:
MnO2 + 4HCl = MnCl2 + Cl2↑ + 2H2O
При этом аквакомплексы не образуются. При взаимодействии с горячей серной или азотной кислотой диоксид марганца разлагается с выделение кислорода. В качестве дешевого окислителя диоксид марганца широко используется в технике и лабораторной практике.
При взаимодействии MnО2 с наиболее сильными окислителями проявляет восстановительные свойства, образуются производные марганца (VI) и (VII), например
3MnO2 + КС1О3+6KOH сплав 3K2MnO4 + КС1 + 3H2O
2MnО2 + 3PbO2 + 6HNO3 → 2НMnO4 +3Pb(NO3)2 + 2H2O
18. Соединения марганца в с.о. +7: оксид, гидроксид, соли, роль соединений в ОВ- реакциях, зависимость глубины окисления от силы окислителя и реакции среды.
Оксид Mn (VII) можно получить по реакции:
2KMnO4 (тверд.) + Н2 SO4 → Mn2O7 + К2 SO4 + Н2О.
Оксидам Э(VII) соответствуют кислоты НЭO4, которые существуют в растворе. Кислотам отвечают соли КЭO4, большинство из которых растворимы в воде.
KMnO4 легко разлагается при нагревании: 2KMnO4 → K2MnO4 + MnO2 +О2.
Соединения Mn(VII) являются сильными окислителями. Глубина восстановления перманганата зависит от реакции среды и силы восстановителя, наиболее сильным окислителем он является в кислой среде.
5Na2SO3 + 2KMnO4 + 3H2SO4 → 2MnSO4 + 5Na2SO4 + 3H2O
3 Na2SO3 + 2KMnO4 + H2O = 2MnO2↓ + 3Na2SO4 + 2KOH
Na2SO3 + 2KMnO4 + 2КOН → 2K2MnO4+ Na2SO4 + H2O
19. Соединения хрома в степени окисления +3: оксид, гидроксид, доказать их кислотно-основные свойства, соли, роль в ОВ реакциях.
Для хрома степень окисления +3 является наиболее устойчивой. Координационное число хрома (111) равно шести, его комплексы имеют структуру октаэдра. Оксид хрома (III) –химически устойчивый, нерастворимый в воде и кислотах зеленый порошок. Он тугоплавок, твердоссть его кристаллов соизмерима с твердостью корунда. Оксид хрома (111) можно получить по следующим реакциям:
Na2Cr2O7 + 2C tº Cr2O3 + Na2CO3 + CO
(NH4)2Cr2O7 tº Cr2O3 + N2 + 4H2O
Амфотерная природа Сr2О3 проявляется при сплавлении со щелочами и пиросульфатом калия:
Cr2O3 + 2NaОНà 2 NaCrO2 + Н2O
Cr2O3 + 3 K2S2O3 à(tº) Cr2(SO4)3 + 3K2SO4
K2S2O3à K2SO4 + SO3
Cr2O3 + 3SO3 à(tº) Cr2 (SO4)3
Оксиду Cr2O3 соответствует гидроксид хром [Cr(OH)3] n – это многоядерный слоистый полимер серо-зеленого цвета, в котором роль лигандов играют ионы гидроксила и молекулы воды, а роль мостиков - группы ОН-. Его состав и структура зависят от условий получения. При старении и, особенно при нагревании, гидроксид хрома. Свежеосажденный гидроксид хрома хорошо растворяется в кислотах и щелочах, которые вызывают разрыв связей в слоистом полимере:
Cr(OH)3 + 3HCl + 3 H2O = [Cr(H2O)6]Cl3
Cr(OH)3 + 3NaOH = Na3[Cr(OH)6]
Для солей хрома характерна гидратная изомерия, в зависимости от числа моль воды во внутренней сфере они окрашены в разные цвета, например,
[Cr(H2O)5Cl]Cl2-светло-зеленый
[Cr(H2O)4Cl2]Cl·2H2O – темно – зеленый
[Cr(H2O)6]Cl3 –фиолетовый
Соли хрома легко подвергаются гидролизу:
CrCl3 + H2O CrOHCl2 + НCl
2 CrCl3 + 3Na2СO3 +3H2O = 2Cr (OH)3 + 3CO2 + 6NaCl
Хром (III) весьма склонен к образованию комплексов как анионного, так и катионного типа, координационное число равно шести, что соответствует d2sp3 – гибридизации.
Соединения Сr3+ являются восстановителями:
2CrCl3 + 3H2O2 + 10 NaOHà 2NaCrO4 + 6 NaCl + 8H2O
2 Na3[Cr(OH)6] +6Br2 +4NaОН = Na2CrO4 +6NaBr +8Н2О
20. Соединения хрома в с.о. +6: оксид, гидроксиды, соли, роль соединений в ОВ-реакциях.
Соединения хрома в степени окисления +6 многочисленны.
CrO3 получают по реакции:
K2Cr2O7 (тверд.) + H2SO4 (к) = K2SO4 + 2СrО3 + H2O.
Триоксиды – кристаллические вещества CrO3 – темно-красный
CrO3 имеет цепочечную структуру, образованную тетраэдрами CrO4. При нагревании CrO3 довольно легко разлагается с выделением кислорода:
4CrO3 2Cr2O3 + 3O2↑
Со многими окисляющимися веществами CrO3 взаимодействует со взрывом.
CrO3 – ядовит!
CrO3 легко растворяется в воде, образуя хромовую кислоту:
CrO3 + Н2О = Н2CrO4
Хромовая кислота в свободном виде не выделена, она существует только в водном растворе.
Способность к полимеризации у иона CrO4 2- выражена менее отчетливо, тем не менее известны, например, дихромат-K2Cr2O7, трихромат - K2Cr3O10. Полихроматы образуются при действии кислот на хроматы, при этом желтая окраска хроматов изменяется на оранжевую.
2H+ + 2CrO42- ↔ Cr2O72- + H2O.
В результате дальнейшего подкисления раствора концентрированной кислотой при охлаждении выделяются темно- красные кристаллы CrO3:
K2Cr2O7 + H2SO4 = 2CrO3 + K2SO4 + H2O.
Если же на растворы полихроматов действовать щелочью, процесс идет в обратном направлении:
Cr2O72- + 2 OH¯ = 2CrO42- + H2O.
Из оксохроматов наибольшее значение имеют соли натрия и калия, которые получают сплавлением Cr2O3 с соответствующими карбонатами на воздухе при 1000-13000С.
Cr2O3 + 2Na2CO3 + 3O2 = 2Na2CrO4 + 2CO2.
Все соли, содержащие Сr (VI), являются сильными окислителями. В кислой среде образуются производные катионного комплекса [Cr(H2O)6]3-:
K2Cr2O7 +3Na2SO4 +4H2SO4 =Cr2(SO4)3 + 3Na2SO4 + K2SO4 +4H2O
В нейтральной среде образуется гидроксид хрома (lll):
3(NH4)2S + K2Cr2O7 + 7H2O = 2Cr(OH)3↓ + 6 NH4ОН + 3S↓ + 2KOH
В щелочной – производные комплекса [Cr(OH)6]3-:
3(NH4)2S + K2Cr2O7 + 4 KOH + 7H2O = 2K3[Cr(OH)6] + 3S↓ + 6NH4ОН
Наибольшая окислительная активность соединений Сr6+ проявляется в кислой среде.
21. Соединения меди в с.о.+1, +2, +3: оксиды, гидроксиды, соли, роль соединений в ОВ- реакциях.
Степень окисления +1
4CuCl + O2 +6 HCl = 4CuCl2 + 2H2O
Гидроксиды ЭОН неустойчивы, являются слабыми основаниями!
Аммиачные комплексы значительно более устойчивы и по силе приближаются к щелочам
Степень окисления +2
Cu(OH)2 + 2H+ = Cu 2+ + 2H2O
Cu(OH)2 + 2 OH- (конц.) = [Cu(OH)4 ] 2-
Cu(II) в ОВР проявляют как окислительные, так и восстановительные свойства:
2Cu(OH)2 + NaClO + 2NaOH = 2NaCuO2 + NaCl + 3H2O
2CuCl2 + 4 KI → 2Cu2I2 + I2 + 4KCl
Комплексные соединения Cu (+2)
• CuSO4 + 5H2O = [Cu(H2O)4]SO4 *H2O
• CuSO4 + 4NH3 (конц.) = [Cu(NH3)4]SO4
Степень окисления +3
Соединения Cu(III) – куприты – неустойчивы, существуют только в сильно щелочных растворах: 4NaCuO2 + 12HCl = 4NaCl + 4CuCl2 + 6H2O + O2
Степени окисления III и IV являются малоустойчивыми степенями окисления и представлены только соединениями с кислородом, фтором или в виде комплексов.
Оксид меди(III) не получен. Под этим названием описаны различные купраты(III).
Гексафторкупраты(III) и (IV) получают действием фтора на соли меди и щелочных металлов при нагревании под давлением. Они бурно реагируют с водой и являются сильными окислителями.
Комплексы меди(III) с ортопериодатами и теллуратами относительно стабильны и предложены как окислители в аналитической химии. Описано много комплексов меди(III) с аминокислотами и пептидами.
22. Соединения цинка, кадмия и ртути в с.о. +2: оксиды, гидроксиды, соли, роль соединений в ртути ОВ- реакциях.
Получение:
Гидроэлектрометаллургический:
окисление: 2ZnS + 3O2 = 2ZnO + 2SO2↑
обработка H2SO4 (р): ZnS + H2SO4 = ZnSO4 + H2O
электролиз раствора ZnSO4: K(–) Zn2+ + 2ē =Zn0
Пирометаллургический:
ZnS + 3O2 = 2ZnO + 2SO2↑
ZnO + C = Zn↑ + CO↑
HgS + O2 = Hg + SO2
В ряду ZnО, СdO, HgО термическая устойчивость оксидов уменьшается
• 2Zn + O2 = 2ZnO
• 2Cd + O2 = 2CdO
В ряду ZnS – CdS – HgS растворимость понижается
ZnS + 2HCl(p.) = ZnCl2 + H2 S↑
CdS+ 4 HCl(K.)= H2 [CdCl4 ] + H2 S↑
3HgS + 8HNO3 = 3Hg(NO3)2 +3S↓ + 2NO +4H2O
Zn2+ + 2OH- = Zn(OH)2↓
Cd 2+ + 2 OH- = Cd(OH)2↓
В ряду Zn(ОН)2 – Сd(ОН)2 основные свойства усиливаются. Устойчивость соединений снижается при переходе от Сd к Нg. Zn(ОН)2 и Сd(ОН)2 устойчивы, а гидроксид Hg (II) неизвестен.
Hg(NO3)2 + 2NaOH = HgO↓ + NaNO3+ H2O
Hg2(NO3)2 + 2NaOH = 2NaNO3 + Hg2O ↓ + H2O
Zn(OH)2 + 2H+ = Zn2+ + 2H2O
Zn(OH)2 + 2OH‾ = [Zn(OH)4 ] 2-
ZnCl2 + H2O ↔ ZnOHCl + HCl
Zn2+ +НОН↔ ZnOH+ + H+
При длительном нагревании: Cd(OH)2 + 4 NaOH (конц.) = Na4 [Cd(OH)6 ]
Комплексообразование ионов Zn2+, Cd2+, Hg2+
Zn(OH)2 + 4NH4OH = [Zn(NH3)4 ](OH)2 + 4H2O
Hg(NO3)2 +2KI = 2KNO3 + HgI2↓
2KI + HgI2 = K2 [HgI4]
В отличие от сульфидов цинка и кадмия, HgS растворяется в избытке сульфидов щелочных металлов с образованием КС: HgS + K2 S = K2 [HgS2]
 2020-08-05
2020-08-05 1040
1040
