Задача настоящей работы заключалась в создании тест-системы для определения остаточных количеств ХАФ в цельном молоке.
Прежде всего необходимо было подобрать условия для свободного протекания анализируемого образца вдоль тест-полоски, поскольку молоко является достаточно сложной биологической жидкостью, и в неразбавленном виде плохо течет по мембране. Для проведения анализа молоко разбавляли в 4 раза ФБСТ (разбавление молока в 2 раза было недостаточным), предел обнаружения разработанного метода позволяет это делать.

Рис. 9. Градуировочные зависимости в молоке (1:3 в ФБСТ) и в буферном растворе
Из градуировочных зависимостей на рис. 9 видно, что кривые, полученные на основе стандартных растворов ХАФ в буферном растворе и на основе стандартов ХАФ в разбавленном молоке (3,2%, Домик в деревне) сильно расходятся. Такое явление объясняют наличием матричного эффекта, подразумевая под этим влияние состава анализируемой жидкости на интенсивность сигнала. В молоке содержится множество белков и жиров, которые могут оказывать существенное влияние на результаты анализа.
Существует два основных подхода для преодоления матричного эффекта – это простое разбавление образцов буферным раствором, что в данном случае не привело к желаемому результату.
Второй способ – использование специальных мембран для нанесения образца. Используемая в предыдущих экспериментах мембрана MAPDS-0300 изготовлена из стекловолокна и не содержит в своем составе дополнительных реагентов. В работе протестировали мембраны для нанесения образца – GFB-R7L и GFB-R4, изготовленные из целлюлозного волокна и отличающиеся между собой методами предобработки. Мембрана GFB-R4 не содержит в своем составе дополнительных веществ, а в составе GFB-R7L присутствуют соли и детергенты.
Полученные результаты представлены на рис. 10.
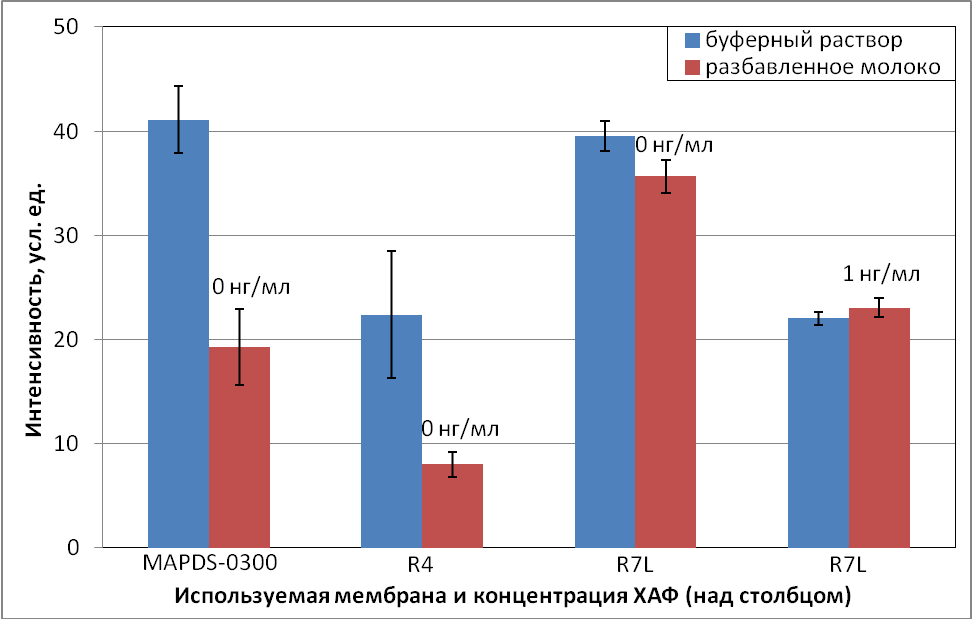
Рис. 10. Сравнение интенсивности сигнала в буферном растворе и разбавленном молоке (1:3 в ФБСТ) в зависимости от используемой мембраны
Опираясь на данные гистограммы, для определения ХАФ в молоке наиболее подходит мембрана GFB-R7L. Интенсивности сигналов были наиболее близки в буферном растворе и молоке для 0 и 1 нг/мл ХАФ. Вероятно, присутствие в ее составе дополнительных реагентов улучшает капиллярное течение молока, уменьшая тем самым матричный эффект.
Таким образом, для определения ХАФ в молоке необходимо предварительно разбавлять образцы молока в 4 раза буферным раствором и использовать мембрану для нанесения образца GFB-R7L.
Выводы
В ходе проведённых исследований:
- получены специфические иммунореагенты разного состава: конъюгат хлорамфеникола с бычьим сывороточным альбумином (ХАФ-БСА) и конъюгат специфических антител с наночастицами золота (Ат-НЧЗ);
- установлено, что оптимальные соотношения составов иммунореагентов: ХАФ-БСА 20:1, Ат-НЧЗ 50% и ХАФ-БСА 5:1, Ат-НЧЗ 100%;
- разработана методика определения ХАФ в буферном растворе методом ИХА, пределы обнаружения и определения составили 0,04 нг/мл и 0,06 нг/мл, соответственно; относительное стандартное отклонение не превышало 10%;
- показано, что для определения ХАФ в молоке лучше использовать мембрану GFB-R7L, а молоко следует предварительно разбавить в 4 раза буферным раствором.
Список литературы
[1]. Zhang G., Guo J., Wang X. Immunochromatographic Lateral Flow Strip Tests // Methods Mol. Biol. 2009. V. 504. P. 169—183. (doi:10.1007/978-1-60327-569-9_12)
[2]. Posthuma-Trumpi G., Korf J., van Amerongen A. Lateral flow (immuno)assay: its strengths, weaknesses, opportunities and threats. A literature survey // Anal. Bioanal.Chem. 2009. V. 393. №2. P. 569—582.
[3]. Егоров Н.С. Основные учения об антибиотиках. М.: Изд-во МГУ; Наука, 2004. С. 528.
[4]. Wilson R. The use of gold nanoparticles in diagnostics and detection // Chem. Soc. Rev. 2008. V. 37. P. 2028—2041.
[5]. Wong R C, Tse H.Y. Lateral Flow Immunoassay. NY USA: Humana Press, 2009. P. 223.
[6]. Морозова В.С., Габрильянц О.А., Мягкова М.А. Диагностика и профилактика заболеваний зависимости. М.: Академия Естествознания, 2015. С. 177.
[7]. https://www.sigmaaldrich.com/content/dam/sigma-aldrich/docs/Sigma-Aldrich/General_Information/1/tb500en00em-rapid-lateral-flow-test-strips.pdf
[8]. Khreich N., Lamourette P., Boutal H., Devilliers K., Creminon C., Volland H. Detection of Staphylococcus enterotoxin B using fluorescent immunoliposomes as label for immunochromatographic testing // Anal. Biochem. 2008. V. 377. №2. P. 182—188.
[9]. Edwards K.A., Baeumner A.J. Optimization of DNA-tagged dye-encapsulating liposomes for lateral-flow assays based on sandwich hybridization // Anal. Bioanal.Chem. 2006. V. 386. №5. P. 1335—1343.
[10]. Van Amerongen A., Wichers J.H., Berendsen L.B.J.M., Timmermans A.J.M., Keizer G.D., van Doorn A.W.J., Bantjes A. van Gelder W.M.J. Colloidal carbon particles as a new label for rapid immunochemical test methods: Quantitative computer image analysis of results // J. Biotechnol. 1993. V. 30. №2. P.185—195.
[11]. Goryacheva I.Y., Lenain P., De Saeger S. Nanosized labels for rapid immunotests // TrAC, Trends Anal. Chem. 2013. V. 46. P 30—43.
[12]. Linares E.M., Kubota L.T., Michaelis J., Thalhammer S. Enhancement of the detection limit for lateral flow immunoassays: Evaluation and comparison of bioconjugates // J. Immunol. Methods. 2012. V. 375. №1-2. P. 264—270.
[13]. Hagan A.K., Zuchner T. Lanthanide-based time-resolved luminescence immunoassays // Anal. Bioanal.Chem. 2011. V. 400. №9. P. 2847—2864.
[14]. Sund H., Blomberg K., Meltola N., Takalo H. Design of Novel, Water Soluble and Highly Luminescent Europium Labels with Potential to Enhance Immunoassay Sensitivities // Molecules. 2017. V. 22. №10. P. 1807.
[15]. Obonyo O., Fisher E., Edwards M., Douroumis D. Quantum dots synthesis and biological applications as imaging and drug delivery systems // Crit. Rev. Biotechnol. 2010. V. 30. №4. P. 283—301.
[16]. Jahangir M.A., Gilani S.J., Muheem A., Jafar M., Aslam M., Ansari M.T., Abul Barkat M. Quantum Dots: Next Generation of Smart Nano-Systems // Pharm. Nanotechnol. 2019. V. 7. №3. P. 234—245.
[17]. Taranova N.A., Berlina A.N., Zherde v A.V., Dzantiev B.B. “Traffic light” immunochromatographic test based on multicolor quantum dots for the simultaneous detection of several antibiotics in milk // Biosens. Bioelectron. 2015. V. 63. P. 255—261.
[18]. Stults N. L., Stocks N.F., Rivera H., Gray J., McCann R.O., O’Kane D., Cummings R.D., Cormier M.J., Smith D.F. Use of recombinant biotinylated aequorin in microtiter and membrane-based assays: Purification of recombinant apoaequorin from Escherichia coli // Biochemistry. 1992. V. 31. №5. P. 1433—1442.
[19]. Liotta L.A., Christiansen B.C., Day A.R., Harlacher T., Paweletz K. Light emitting immunoassay. №US patent 5942407. Application 08/882594 from 25.06.1997, publ. 24.08.1999.
[20]. Wang Y., Xu H., Wei M., Gu H., Xu Q., Zhu W. Study of superparamagnetic nanoparticles as labels in the quantitative lateral flow immunoassay // Mater. Sci. Eng., C. 2009. V. 29. №3. P. 714—718.
[21]. Connolly R., O’Kennedy R. Magnetic lateral flow immunoassay test strip development – Considerations for proof of concept evaluation // Methods (Amsterdam, Neth.). 2017. V. 116. P. 132—140.
[22]. Mohamad Nor N., Abdul Razak K., Tan S.C., Noordin R. Properties of surface functionalized iron oxide nanoparticles (ferrofluid) conjugated antibody for lateral flow immunoassay application // J. Alloys Compd. 2012. V. 538. P. 100—106.
[23]. Madison R., Maklins J.D. Latex nanospheres delivery systems // Brain Res. 1990. V. 7. №3. P. 187—192.
[24]. Ling S., Li X., Zhang D., Wang K., Zhao W., Zhao Q., Wang R., Yuan J., Xin S., Wang S. Detection of okadaic acid (OA) and tetrodotoxin (TTX) simultaneously in seafood samples using colloidal gold immunoassay // Toxicon. 2019. V. 165. P. 103—109.
[25]. Дыкман Л.Г., Богатырев В.А. Наночастицы золота: получение, функционализация, использование в биохимии и иммунохимии. // Успехи химии. 2007. Т. 76. №2. С. 199—213.
[26]. Хлебцов Н.Г., Богатырев В.А., Дыкман Л.Г., Хлебцов Б.Н. Плазмонно-резонансные наночастицы для биодиагностики и медицины.// Нанотехника. 2007. №2. С. 77—80.
[27]. Frens G. Controlled Nucleation for the Regulation of the Particle Size in Monodisperse Gold Suspensions // Nature (London), Phys. Sci. 1973. V. 241. №105. P. 20—22.
[28]. https://eur-lex.europa.eu/legal-content/EN/TXT/PDF/?uri=CELEX:32003D0181&from=LV (19.05.2020)
[29]. https://sudact.ru/law/reshenie-soveta-evraziiskoi-ekonomicheskoi-komissii-ot-09102013_3/tr-ts-0332013/prilozhenie-n-4/ (19.05.2020)
[30]. Ding S., Shen J., Zhang S., Jiang H., Su Z. Determination of Chloramphenicol Residue in Fish and Shrimp Tissues by Gas Chromatography with a Microcell Electron Capture Detector // J. AOAC Int. 2005. V. 88. №1. P. 57—60.
[31]. Sanchez-Brunete C., Albero B., Miguel E., Tadeo J.L. Rapid Method for Determination of Chloramphenicol Residues in Honey Using Gas Chromatography-Mass Spectrometry // Bull. Environ. Contam. Toxicol. 2005. V. 75. №3. P. 459—465.
[32]. Guidi L. R., Tette P.A.S., Fernandes C., Silva L.H.M., Gloria M.B.A. Advances on the chromatographic determination of amphenicols in food // Talanta. 2017. V. 162. P. 324—338.
[33]. Xie Y., Hu Q., Zhao M., Cheng Y., Guo Y., Qian H., Yao W. Simultaneous Determination of Erythromycin, Tetracycline, and Chloramphenicol Residue in Raw Milk by Molecularly Imprinted Polymer Mixed with Solid-Phase Extraction // Food Anal. Methods. 2017. V. 11. №2. P. 374—381.
[34]. Han J., Wang Y., Yu C., Yan Y., Xie X. Extraction and determination of chloramphenicol in feed water, milk, and honey samples using an ionic liquid/sodium citrate aqueous two-phase system coupled with high-performance liquid chromatography // Anal. Bioanal. Chem. 2011. V. 399. №3. P. 1295—1304.
[35]. Tu C., Guo Y., Dai Y., Wei W., Wang W., Wu L., Wang A. Determination of Chloramphenicol in Honey and Milk by HPLC Coupled with Aptamer-Functionalized Fe3O4/Graphene Oxide Magnetic Solid-Phase Extraction // J. Food Sci. 2019. V. 84. №12. P. 3624—3633.
[36]. Wang H., Zhou X.-J., Liu Y.-Q., Yang H.-M., Guo Q.-L. Simultaneous Determination of Chloramphenicol and Aflatoxin M1Residues in Milk by Triple Quadrupole Liquid Chromatography−Tandem Mass Spectrometry // J. Agric. Food Chem. 2011. V. 59. №8. P. 3532—3538.
[37]. Wang L., Zhang Y., Gao X., Duan Z., Wang,S. Determination of Chloramphenicol Residues in Milk by Enzyme-Linked Immunosorbent Assay: Improvement by Biotin−Streptavidin-Amplified System // J. Agric. Food Chem. 2010. V. 58. №6. P. 3265—3270.
[38]. Chughtai M.I., Maqbool U., Iqbal M., Shah M.S., Fodey T. Development of in-house ELISA for detection of chloramphenicol in bovine milk with subsequent confirmatory analysis by LC-MS/MS // J. Environ. Sci. Health, Part B. 2017. V. 52. №12. P. 871—879.
[39]. Scortichini G., Annunziata L., Haouet M.N., Benedetti F., Krusteva I., Galarini R. ELISA qualitative screening of chloramphenicol in muscle, eggs, honey and milk: method validation according to the Commission Decision 2002/657/EC criteria // Anal. Chim. Acta. 2005. V. 535. №1-2. P. 43—48.
[40]. Федорова М.Д., И.П.Андреева И.П., Вылегжанина Е.С., Комаров А.А., Рубцова М.Ю., Самсонова Ж.В., Егоров А.М. Иммуноферментный анализ хлорамфеникола в продуктах питания // Биотехнология. 2009. №6. С. 79—87.
[41]. Zhang S., Zhang Z., Shi W., Eremin S.A., Shen J. Development of a Chemiluminescent ELISA for Determining Chloramphenicol in Chicken Muscle // J. Agric. Food Chem. 2006. V. 54. №16. P. 5718—5722.
[42]. Byzova N.A., Zvereva E.A., Zherdev,A.V., Eremin S.A., Dzantiev B.B. Rapid pretreatment-free immunochromatographic assay of chloramphenicol in milk // Talanta. 2010. V. 81 №3. P. 843—848.
[43]. Zhou J., Nie W., Chen Y., Yang C., Gong L., Zhang C., Chen Q., He L., Feng, X. Quadruplex gold immunochromatogaraphic assay for four families of antibiotic residues in milk // Food Chem. 2018. V. 256. P. 304—310.
[44]. Hendrickson O.D., Zvereva E.A., Shanin I.A., Zherdev A.V., Dzantiev B.B. Development of a multicomponent immunochromatographic test system for the determination of fluoroquinolone and amphenicol antibiotics in dairy products // J. Sci. Food Agric. 2019. V. 99. №8. P. 3834—3842.
[45]. Berlina A.N., Taranova N.A., Zherdev A.V., Vengerov Y.Y., Dzantiev B.B. Quantum dot-based lateral flow immunoassay for detection of chloramphenicol in milk // Anal. Bioanal. Chem. 2013. V. 405. №14. P. 4997—5000.
[46]. Qie Z., Yan W., Gao Z., Meng W., Xiao R., Wang S. An anti-BSA antibody-based immunochromatographic assay for chloramphenicol and aflatoxin M1 by using carboxy-modified CdSe/ZnS core–shell nanoparticles as label // Microchim. Acta. 2020. V. 187. №1.
[47]. Liu S., Bai J., Huo Y., Ning B., Peng Y., Li S., Han D, Kang W, Gao Z. A zirconium-porphyrin MOF-based ratiometric fluorescent biosensor for rapid and ultrasensitive detection of chloramphenicol // Biosens. Bioelectron. 2019. Pre-proof.
[48]. Javidi M., Housaindokht M.R., Verdian A., Razavizadeh B.M. Detection of chloramphenicol using a novel apta-sensing platform based on aptamer terminal-lock in milk samples // Anal. Chim. Acta. 2018. V. 1039. P. 116—123.
[49]. Govindasamy M., Chen S.-M., Mani V., Devasenathipathy R., Umamaheswari R., Joseph Santhanaraj K., Sathiyan, A. Molybdenum disulfide nanosheets coated multiwalled carbon nanotubes composite for highly sensitive determination of chloramphenicol in food samples milk, honey and powdered milk // J. Colloid Interface Sci. 2017. V. 485. P. 129—136.
[50]. https://www.made-in-china.com/factory/chloramphenicol-rapid-test.html (24.05.2020)
[51]. http://тесты-антибиотики.рф (24.05.2020)
 2020-08-05
2020-08-05 127
127







