Растворимость соли C (моль×дм–3) – это ее равновесная молярная концентрация в насыщенном растворе. В случае малорастворимой соли ее растворимость в единицах молярной концентрации можно рассчитать, измерив электрическую проводимость насыщенного раствора такой соли по уравнению:
C =  kсоли. (2.1)
kсоли. (2.1)
Молярная электрическая проводимость такого раствора (l) практически равна молярной проводимости его при бесконечном разведении (l¥), вследствие малой концентрации электролита в растворе. Величину l¥ можно рассчитать по справочным данным, используя уравнение
l¥ = l+¥ + l–¥ (2.2)
Вместо удельной электрической проводимости соли (kсоли) используют разность (kр–ра – kводы), так как проводимости воды (kводы) и раствора (kр–ра) в этом случае соизмеримы. Таким образом, определив величину l¥ и удельные электрические проводимости воды и раствора исследуемой соли, можно вычислить растворимость соли по уравнению
C = 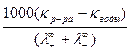 , моль×дм–3. (2.3)
, моль×дм–3. (2.3)
Зная растворимость соли, определяют ее произведение растворимости (KS), то есть константу равновесия гетерогенной реакции растворения малорастворимой соли:
Mn+An– (тв.) «n+Mz+(aq) + n–Az–(aq). (2.4)
Константа равновесия такой реакции, называемая произведением растворимости соли, равна:
KS = a+ n+× a– n–, (2.5)
где a+ и a– – активности катиона и аниона в растворе, n+ и n– – число катионов и анионов в составе электролита. Если в растворе отсутствуют электролиты, содержащие ионы исследуемой соли и практически полностью отсутствуют другие электролиты, то, учитывая малую растворимость соли, можно перейти от активностей компонентов к их концентрациям. Тогда из уравнения (2.5) получаем:
KS = C+ n+× C– n–.
Исходя из (2.4) концентрация катионов C + = n+ C и анионов C – = n– C. Тогда получаем:
KS = C nn+n+n–n–, (2.6)
где n+ + n– = n, С – молярная концентрация соли в исследуемом растворе (растворимость соли).
Таким образом, произведение растворимости малорастворимой соли определяется концентрацией насыщенного раствора этой соли и числом ее ионов в растворе.
Например:
1. AgCl «Ag+ + Cl–; n+ = 1; n– = 1; n = 2; KS = C 2×11×11 = C 2.
2. MgSO4 «Mg2+ + SO4 2–; n+ = 1; n– = 1; n = 2; KS = C 2×11×11 = C 2.
3. CaCl2 «Ca2+ + 2Cl–; n+ = 1; n– = 2; n = 3; KS = C 3×22×11 = 4 C 3.
4. Ca3(PO4)2 «3Ca2+ + 2PO4 2–; n+ = 3; n– = 2; n = 5; KS = C 5×33×22 = 108 C 5.
Лабораторной работе должен предшествовать опыт по определению постоянной сосуда для электрохимических измерений. Если работы выполняются на одной установке в течение одного лабораторного занятия, то достаточно этот опыт провести один раз.
Определение постоянной сосуда (j)
Постоянной сосуда является отношение расстояния между электродами (l) к площади каждого из электродов (S), используемых в электрохимической ячейке для измерения электропроводности раствора (L). Она определяется экспериментально. Для этого измеряют электрическую проводимость раствора (L), удельная электрическая проводимость которого известна. Обычно для этой цели используется 0,01 М раствор KCl. Значение k для этих растворов для заданной температуры берут из приложения. Тогда, для полученных значений k и R рассчитывают постоянную сосуда (j) по уравнению для удельной электропроводности k
k = 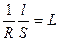 j, (2.7)
j, (2.7)
где  j – постоянная сосуда.
j – постоянная сосуда.
Отсюда j =  kKCl R KCl =
kKCl R KCl =  , см–1. (2.8)
, см–1. (2.8)
Сосуд для измерения вместе с электродами промывают дистиллированной водой и исследуемым раствором. Затем в сосуд помещают 20 см3 0,01 М раствора KCl, при этом электроды должны быть полностью покрыты раствором. Электроды сосуда подсоединяют к измерительной цепи и определяют его электрическую проводимость (L), после чего рассчитывают постоянную сосуда по уравнению (2.8).
 2020-08-05
2020-08-05 127
127








