1. Определяют константу прибора j по методике, описанной выше.
2. Определяют удельную электропроводность воды. Для этого 20 см3 дважды перегнанной воды помещают в сосуд для кондуктометрических измерений. Измеряют электропроводность воды и рассчитывают ее удельную электропроводность (kводы) по уравнению (2.7).
3. Измеряют электропроводность насыщенного раствора соли. Для этого раствор слегка взбалтывают; 20 см3 мутного, но без осадка, раствора переносят в измерительный сосуд. Дождавшись осветления раствора, производят измерение его сопротивления. Рассчитывают удельную электропроводность раствора соли (kсоли) по уравнению (2.7), растворимость соли по уравнению (2.3) и произведение растворимости по уравнению (2.6).
4. Экспериментальные и расчетные данные заносят в таблицу. Полученный результат сопоставляют со справочным значением произведения растворимости данной соли.
Рекомендуемый вид таблицы
Электролит:
Температура опыта:
| № | L,См | k, См× см–1 | kсоли = kр–ра – kводы, См×см–1 | l¥, см2×См×моль–1 | Растворимость, С, моль×дм–3 | Произведение растворимости, KS | |
| 1 | Вода | ||||||
| 2 | Раствор соли |
Работа № 3
Определение среднего коэффициента активности
Электролита методом потенциометрии
Цель работы
Усвоить теоретические сведения о природе электрохимического потенциала, влиянии ряда факторов на его величину; освоить методику экспериментального определения величины ЭДС гальванического элемента, составленного из стеклянного и хлоридсеребряного электродов в растворах хлороводородной кислоты; определить стандартную величину ЭДС используемого гальванического элемента и рассчитать значения среднего коэффициента активности растворов.
Вопросы коллоквиума
1. Физический смысл величины электродного потенциала. Стандартный электродный потенциал. Зависимость электродного потенциала от концентрации раствора электролита. Уравнение Нернста.
2. Гальванический элемент. Зависимость ЭДС гальванического элемента от концентрации электролита. Связь величины ЭДС гальванического элемента с термодинамическим потенциалом.
3. Типы электродов.
4. Примеры химических и концентрационных цепей.
5. Применение потенциометрического метода для определения коэффициента активности раствора электролита.
Приборы и реактивы
1. Учебно-лабораторный комплекс «Химия» в следующей комплектации:
– центральный контроллер,
– модуль «Электрохимия» в комплекте со стаканчиком (50см3), датчиком температуры, стеклянным и хлоридсеребряным электродами и шнурами для присоединения электродов;
2. Раствор соляной кислоты с известной концентрацией (0,1М), дистиллированная вода, раствор нитрата серебра (примерно 0,01М);
3. Две пипетки на 10 см3, лабораторная посуда.
Методика выполнения работы и её обоснование
Для определения среднего коэффициента активности электролита необходимо составить элемент, состоящий из электродов обратимых относительно катиона и аниона исследуемого электролита. Кроме того, чтобы исключить возникновение диффузионного потенциала, элемент не должен содержать жидкостной границы. Для определения среднего коэффициента активности раствора соляной кислоты можно использовать гальванический элемент, состоящий из хлоридсеребряного (ХСЭ) и стеклянного электродов.
Ag | AgCl | HCl(aq) | стекло | HCl(0,1M) | AgCl | Ag,
ЭДС этого гальванического элемента будет:
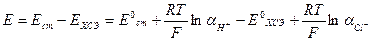
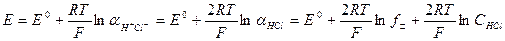 Учитывая, что Е° = Е°ст -Е°хсэ, получим
Учитывая, что Е° = Е°ст -Е°хсэ, получим
После небольших преобразований получим (3.1)

Для предельно разбавленного раствора
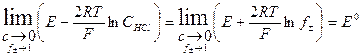
Обозначим 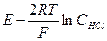 = y. Согласно теории Дебая - Хюккеля для разбавленных растворов должна наблюдаться прямолинейная зависимость в координатах у – C 1/2 . Таким образом, экстраполируя зависимость до нулевой концентрации, мы можем определить значение стандартной ЭДС используемого гальванического элемента.
= y. Согласно теории Дебая - Хюккеля для разбавленных растворов должна наблюдаться прямолинейная зависимость в координатах у – C 1/2 . Таким образом, экстраполируя зависимость до нулевой концентрации, мы можем определить значение стандартной ЭДС используемого гальванического элемента.
Зная значение стандартной величины ЭДС, можно рассчитать средний коэффициент активности раствора соляной кислоты, используя уравнение (3.1).
 2020-08-05
2020-08-05 127
127








