Содержание
Общие методические указания…………………………………………………..4
Вопросы коллоквиума к разделу «Электрохимия»…………………………4
Учебно-методические материалы……………………………………………5
Лабораторные работы…………………………………………………………6
Работа № 1 Определение константы и степени диссоциации слабого
электролита………………………………………………………6
Работа № 2 Определение растворимости и произведения
растворимости малорастворимой соли………………………..10
Работа № 3 Определение среднего коэффициента активности
электролита методом потенциометрии………………………..13
Работа № 4 Определение значений водородного показателя (рН)
водных растворов……………………………………………….15
Работа № 5 Определение ЭДС гальванического элемента
и потенциалов отдельных электродов в зависимости
от концентрации растворов…………………………………….19
Приложения …………………………………………………………………..24
Общие методические указания
Физическая химия относится к числу фундаментальных дисциплин и является теоретической основой для повседневной практической деятельности современного химика. Изучение физической химии обеспечивает развитие и углубление знаний по химическим законам природы и является составной частью подготовки специалистов по фундаментальным наукам. Содержание курса обеспечивает формирование у студентов навыков анализа, управления и интенсификации хода химико-технологических процессов, обоснование выбора типа аппаратуры для проведения технологических процессов. Полученные при изучении курса сведения необходимы для успешной специализации выпускников ПГТУ как в области конкретных технологий, создания и аппаратурного оформления новых технологических процессов и их автоматизации, так и для выполнения научно-исследовательских работ.
Предметом изучения и основными задачами физической химии являются предсказание временного хода химического процесса и конечного результата (состояния равновесия) в различных условиях на основании данных о строении и свойствах частиц веществ, составляющих изучаемую систему.
Программа изучения дисциплины должна обеспечить приобретение знаний, умений и навыков в соответствии с ГОСами высшего профессионального образования.
Основные виды учебных занятий по курсу физической химии слагаются из следующих элементов: посещение лекций и изучение лекционного материала; выполнение индивидуальных расчетных заданий; выполнение лабораторного практикума; индивидуальные консультации; сдача зачета по лабораторному практикуму; сдача экзамена по всему курсу.
Электрохимия – это раздел физической химии, в котором изучают физико-химические свойства ионных систем, а также процессы и явления на границах раздела фаз с участием заряженных частиц (электронов или ионов) и молекул растворителя. Электрохимия состоит из двух частей. Теория растворов электролитов занимается изучением как равновесных, так и неравновесных свойств этих однофазных систем. Электрохимическая термодинамика и кинетика изучает общие условия равновесия на заряженных границах раздела фаз, строение этих границ, механизм и кинетические закономерности перехода заряженных частиц через межфазные поверхности.
Вопросы коллоквиума к разделу «Электрохимия»
1. Основные положения теории электролитической диссоциации
2. Сильные и слабые электролиты. Средний коэффициент активности. Правило ионной силы.
3. Степень и константа диссоциации слабых электролитов. Закон разведения Оствальда.
4. Теория растворов сильных электролитов. Предельный закон Дебая–Хюккеля.
5. Электрическая проводимость растворов электролитов. Удельная и молярная электрические проводимости.
6. Зависимость электрической проводимости растворов слабых и сильных электролитов от концентрации электролита.
7. Электрофоретическое и релаксационное торможение в растворах сильных электролитов.
8. Подвижность ионов и числа переноса.
9. Скачки потенциалов на границах фаз. Двойной электрический слой.
10. ЭДС гальванического элемента. Вывод уравнения Нернста.
11. Методы измерения ЭДС. Зависимость ЭДС от температуры.
12. Типы электродов, используемых в потенциометрии. Определение потенциала электрода.
13. Электрохимические цепи. Связь ЭДС электрохимического элемента с термодинамическими параметрами системы.
14. Элементы кинетики электрохимических реакций. Перенапряжение. Уравнение Тафеля.
Учебно-методические материалы
Литература основная
1. Стромберг А.Г., Семченко Д.П. Физическая химия. М.: Высш. шк., 2003. 527 с.
2. Жуховицкий А.А., Шварцман Л.А. Физическая химия. М.: Металлургия, 2001. 668 с.
3. Вольхин В.В. Общая химия. В 3-х кн. Кн. 1. Основной курс. Пермь: Перм. гос. техн. ун-т, 2006. 464 с.
4. Краснов К.С., Воробьев Н.К., Годнев И.Н. и др. Физическая химия. В 2-х кн. Кн. 2. Электрохимия. Химическая кинетика и катализ. М.: Высш. шк., 2001. 319 с.
5. Каретников Г.С., Кудряшов И.В. Сборник примеров и задач по физической химии. М.: Высш. шк., 1998. 527 с.
6. Еремин В.В., Каргов С.И., Успенская И.А. и др. Задачи по физической химии. М.: Экзамен, 2003. 320 с.
7. Практикум по физической химии. Под ред. Горбачева С.В., М.: Высш. шк., 1995.
8. Голиков Г.А. Руководство по физической химии. М.: Высш. шк., 1988. 383 с.
9. Краткий справочник физико-химических величин. Под ред. Равделя А.А., Пономаревой А.М. СПб.: Специальная литература, 1998. 232 с.
10. Методические руководства к лабораторным работам. Колл. препод. кафедры АФХ, Пермь: Перм. гос. техн. ун-т, 1988–1998.
Литература дополнительная
1. Фролов Ю.Г., Белик В.В. Физическая химия. М.: Химия, 1993. 464 с.
2. Киреев В.Д. Курс физической химии. М.: Химия, 1985.
3. Курс физической химии. т. 3. Под ред. Герасимова Я.И. М.: Химия, 1973. 416 с.
4. Эткинс П. Физическая химия. т. 2, М.: Мир, 1980. 584 с.
5. Даниэльс Ф., Олберти Р. Физическая химия. М.: Мир, 1978. 645 с.
6. Практикум по физической химии. Под ред. Мищенко К.П. Л.: Химия, 1988.
7. Антропов Л.И. Теоретическая электрохимия. М.: Высш. шк., 1984. 519 с.
8. Багоцкий В.С. Основы электрохимии. М.: Химия, 1988. 400 с.
9. Корыта И., Дворжак И., Богачкова В. Электрохимия. М.: Мир, 1977. 472 с.
Лабораторные работы
Работа № 1
Определение константы и степени диссоциации
слабого электролита
Цель работы
Исследовать электрические свойства растворов слабых электролитов, рассчитать удельную и молярную электрические проводимости, степень диссоциации и константу диссоциации электролита в растворе. Проверить, подчиняется ли раствор данного вещества закону разведения Оствальда.
Вопросы коллоквиума
1. Растворы электролитов. Теория электролитической диссоциации. Сильные и слабые электролиты. Закон Оствальда.
2. Удельная электрическая проводимость. Зависимость удельной электрической проводимости сильных и слабых электролитов от концентрации и температуры.
3. Эквивалентная и молярная электропроводности. Зависимость эквивалентной и молярной электропроводностей сильных и слабых электролитов от концентрации. Электропроводность при бесконечном разведении.
4. Определение постоянной электрохимического сосуда при измерении сопротивления раствора.
5. Кондуктометрия и ее практическое применение.
6. Порядок выполнения работы и обработки экспериментальных данных.
Приборы и реактивы
1. Учебно – лабораторный комплекс «Химия» в комплектации:
– центральный контроллер;
– модуль «электрохимия» в комплекте с двумя стаканами (50 см3), двумя электродами в одной обойме для кондуктометрических измерений;
0,01 М раствор KCl;
2. Растворы слабых электролитов с концентрацией 0,01 М (уксусная кислота, муравьиная кислота, гидроксид аммония);
3. Мерный цилиндр на 25 см3;
4. Пипетки на 10 и 20 см3;
5. Дистиллированная вода;
6. Лабораторная посуда.
Методика выполнения работы и ее обоснование
Лабораторной работе должен предшествовать опыт по определению постоянной сосуда для электрохимических измерений. Если работы выполняются на одной установке в течение одного лабораторного занятия, то достаточно этот опыт провести один раз.
Определение постоянной сосуда (j)
Постоянной сосуда является отношение расстояния между электродами (l) к площади каждого из электродов (S), используемых в электрохимической ячейке для измерения электропроводности раствора (L). Она определяется экспериментально. Для этого измеряют электрическую проводимость раствора (L), удельная электрическая проводимость которого известна. Обычно для этой цели используется 0,01 М раствор KCl. Значение k для этих растворов для заданной температуры берут из приложения. Тогда, для полученных значений k и R рассчитывают постоянную сосуда (j) по уравнению для удельной электропроводности k
k =  j, (1.1)
j, (1.1)
где 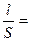 j – постоянная сосуда.
j – постоянная сосуда.
Отсюда j = 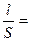 kKCl R KCl =
kKCl R KCl = 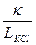 , см–1. (1.2)
, см–1. (1.2)
Сосуд для измерения вместе с электродами промывают дистиллированной водой и исследуемым раствором. Затем в сосуд помещают 20 см3 0,01 М раствора KCl, при этом электроды должны быть полностью покрыты раствором. Электроды сосуда подсоединяют к измерительной цепи и определяют его электрическую проводимость (L), после чего рассчитывают постоянную сосуда по уравнению (1.2).
К равновесию, которое устанавливается в растворе слабого электролита между ионами и молекулами, можно применить законы химического равновесия и записать выражение константы равновесия. Например, для диссоциации уксусной кислоты
CH3COOH «CH3COO– + H+
константа равновесия, выраженная через молярные концентрации реагентов имеет вид
K = 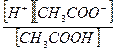 .
.
Константа равновесия процесса диссоциации слабого электролита называется константой диссоциации. Величина K зависит от природы электролита и растворителя, а также от температуры. Она характеризует способность данного электролита распадаться на ионы в растворе. Чем больше K, тем полнее диссоциирует электролит в растворе.
Выражение для константы диссоциации слабого электролита через его начальную концентрацию (С) и степень диссоциации (a) имеет вид
K = 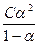 . (1.3)
. (1.3)
Это уравнение для константы диссоциации выражает закон разведения Оствальда.
Степень диссоциации электролита определяют по уравнению
a = 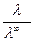 , (1.4)
, (1.4)
где l – молярная электропроводность раствора,
l¥ – молярная электропроводность электролита при бесконечном разведении.
Молярная электрическая проводимость l связана с удельной электрической проводимостью k соотношением
l = 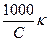 . (1.5)
. (1.5)
Величину l¥ рассчитывают по справочным данным по уравнению
l¥ = l¥+ + l¥–, (1.6)
где l¥+ и l¥– – подвижности ионов при предельном разбавлении.
Экспериментальные данные зависимости электропроводности разбавленного слабого электролита от его концентрации позволяют графически определять величины l¥ и K. Для этого уравнение (1.3) с использованием (1.4) приводят к линейному виду в координатах (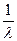 – l С):
– l С):
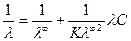 . (1.7)
. (1.7)
Построив график в указанных координатах и продолжив прямую линию графика до пересечения с осью ординат, находят значение l¥ как величину, обратную величине отрезка ординаты, отсекаемой линией графика, а K определяют из уравнения
tg b = 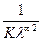 .
.
tg b определяется из треугольника как отношение противолежащего катета к прилежащему в масштабах осей графика (b – острый угол наклона линии зависимости к оси абсцисс).
 2020-08-05
2020-08-05 182
182







