Сложная задача на растворимость
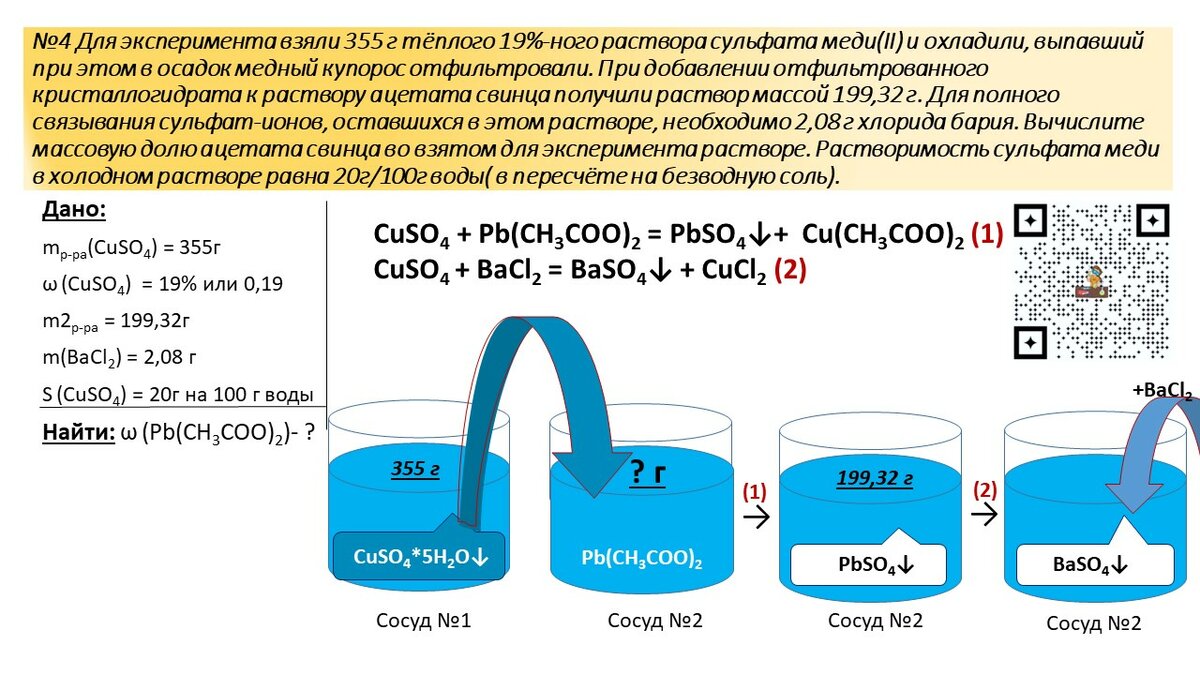
№ 1. Для эксперимента взяли 355 г тёплого 19%-ного раствора сульфата меди(II) и охладили, выпавший при этом в осадок медный купорос отфильтровали. При добавлении отфильтрованного кристаллогидрата к раствору ацетата свинца получили раствор массой 199,32 г. Для полного связывания сульфат-ионов, оставшихся в этом растворе, необходимо 2,08 г хлорида бария. Вычислите массовую долю ацетата свинца во взятом для эксперимента растворе. Растворимость сульфата меди в холодном растворе равна 20г/100г воды (в пересчёте на безводную соль). (Автор: Е. Дацук)

ОВР с пероксидом натрия и количество ионов в 34 задаче на ЕГЭ по химии
№ 1. Пероксид натрия массой 4,68 г внесли в горячую воду. Через полученный после прекращения выделения газа охлажденный 10%-ный раствор пропускали углекислый газ до тех пор, пока он не перестал поглощаться. Затем к раствору добавили при тщательном перемешивании навеску безводного сульфата алюминия, содержащую 4,515·1022 ионов. Вычислите массовые доли веществ в конечном растворе. Растворимостью углекислого газа в воде пренебречь.
Сложность вызывает количество ионов сульфата алюминия. При диссоциации(3 уравнение) из 1 моль сульфата образуется 5 моль ионов, следовательно количество моль сульфата алюминия будет в 5 раз меньше количества моль ионов.


Задачи на пластинки
№1. Чтобы посеребрить медную пластинку массой 10 г, ее опустили в стакан, содержащий 250 г 20 %-ного раствора нитрата серебра. Когда пластинку вынули, оказалось, что масса нитрата серебра в растворе уменьшилась на 20 %. Какой стала масса посеребренной пластинки, и какова концентрация оставшегося раствора нитрата серебра?

№2 Железную пластинку массой 14 г поместили в раствор бромида меди (II) и выдерживали до тех пор, пока ее масса не стала равной 14,4 г. Затем пластинку вынули, высушили и внесли в 400 г подогретого раствора хлорида железа (III), содержащего 1,54*1024 ионов хлорида железа (III). Вычислите массовую долю веществ в полученном растворе.


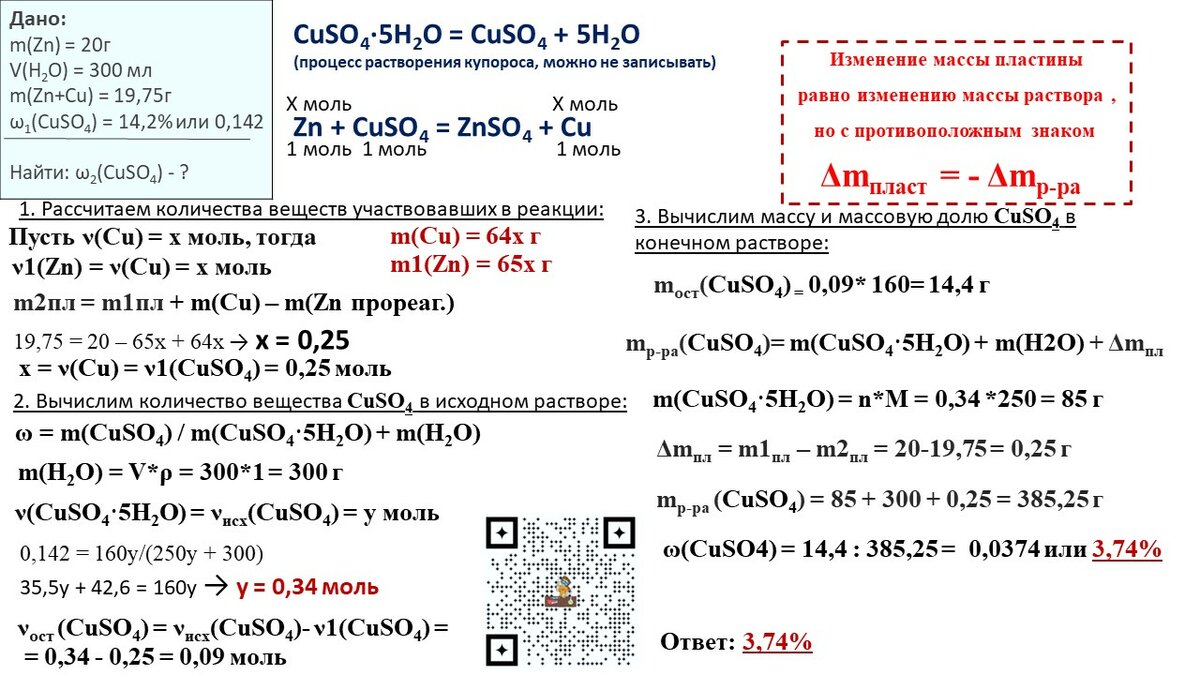
№3 Цинковую пластинку массой 20 г поместили в 14,2-ный % раствор сульфата меди (II), полученный при растворении медного купороса в 300 мл воды. Через некоторое время, пластину вынули и просушили. Масса пластинки составила 19,75 г. Вычислите массовую долю сульфата меди в конечном растворе.

№4. В смеси двух сульфатов железа число атомов кислорода равно числу Авогадро, а соотношение чисел атомов серы и железа составляет 4:3. Эту смесь растворили в воде и в полученный раствор поместили железную пластинку массой 10,5г. Определите массу пластинки после прекращения реакции?

задача: кристаллогидраты, электролиз, растворимость, концентрация ионов.
№1. Электролиз 80 г 22,35%-го раствора хлорида калия продолжали до тех пор, пока на катоде не выделилось 8,96 л (при н.у.) газа. К оставшемуся раствору добавили при небольшом нагревании 8,52 г оксида фосфора (V), полученный раствор охладили. Вычислите массу безводной соли калия, выпавшей в осадок, если ее растворимость в холодном растворе равна 25 г/100 г воды.
В этой задаче три нюанса:
1. Необходимо рассчитать количество хлорида калия, сопоставить его с количеством выделившегося на катоде газа и понять, что кроме электролиза хлорида калия, идёт электролиз воды
2. По соотношению гидроксида калия и оксида фосфора выяснить какая соль образуется: фосфат, гидрофосфат или дигидрофосфат
3. Надо понимать, что такое растворимость и уметь решать с ней задачи

№2. Смесь гексагидрата хлорида кальция и декагидрата карбоната натрия, содержащую 43,2 г кристаллизационной воды, растворили в 250 мл воды, выпавший осадок отделили. В полученном растворе не содержалось ни ионов кальция, ни карбонат-ионов. К полученному раствору добавили 89,25 г раствора хлорида алюминия, в результате массовая доля хлорид-ионов в итоговом растворе оказалась равна 6,39%. Вычислите массовую долю хлорида алюминия в добавленном растворе.
В этой задаче сначала пугают названия веществ: гексагидрат и декагидрат не слабонервных! Но давайте по порядку об особенностях этой задачи:
1. Гексагидрат и декагидрат - кристаллогидраты. Приставки мы с вами отлично знаем из органической химии гекса-6 и дека-10. То есть у хлорида кальция 6 молекул воды, у карбоната натрия 10. Процесс растворения кристаллогидратов в воде записывать необязательно.
2. «В полученном растворе не содержалось ни ионов кальция, ни карбонат-ионов». ЭТО означает, что хлорид кальция и карбонат натрия были взяты в эквимолярных количествах и полностью израсходовались в реакции (карбонат кальция выпал в осадок).
3. Дана не концентрация вещества, а концентрация ионов. Хлорид ионы попали в конечный раствор из хлорида кальция (перешли в хлорид натрия) и хлорида алюминия. Концентрация n(Cl– в NaCl) = n(NaCl) и концентрацию хлорида алюминия считают по концентрации разницы между общим количеством хлорид ионов и количеством хлорид ионов в хлориде натрия n(Cl– в AlCl3) = nобщая(Cl–)- n(Cl– в NaCl). Следовательно: n(AlCl3) = 1/3n(Cl– в AlCl3)


 2020-08-05
2020-08-05 2576
2576