а) Зависимость j (скачка потенциала) от концентрации электролита
Электрохимический элемент состоит из двух полуэлементов или из двух электродов. При соприкосновении каждого такого электрода с раствором на границе раздела металл (электрод) – раствор электролита возникает двойной электрический слой.
В металле:
mCu(металл)=f(T и состава металла). Для данной пластины mCu(металл)=const при Т= const.
В растворе:
mCu2+=f(T и аCu2+)
Пусть mCu(р-р)>mCu(мет), то будет происходить переход ионов Cu2+ на твердую металлическую поверхность пластины, а в растворе будет избыток ионов SO4, т.е. пластина будет заряжена положительно, а раствор отрицательно. При переходе из исходного состояния в состояние равновесия, разность хим. потенциалов меди в растворе и на поверхности будет определять скачок потенциала двойного электрического слоя по формуле:
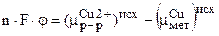
при Т = const; Р= const; DZ=Sm×Dni=mСг2+(-1)+mСu×1=-(mСг2+-mСu)
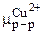 зависит от аCu2+, то изменяя концентрацию Сu2+ в растворе, можно получить на поверхности пластины противоположный заряд, соответствующий переходу ионов меди из металла в раствор. В этом случае: mCu(металл)> mCu(р-р).
зависит от аCu2+, то изменяя концентрацию Сu2+ в растворе, можно получить на поверхности пластины противоположный заряд, соответствующий переходу ионов меди из металла в раствор. В этом случае: mCu(металл)> mCu(р-р).
|
|
|
Можно подобрать такую концентрацию Сu2+ в растворе, когда: mCu(металл)=mCu(р-р) и заряд на электроде будет равен нулю. Такие растворы называются нулевыми растворами.
Пластина меди помещается в чистую воду при Т=const, Р= const. Далее в воду добавляют соль CuSO4 и постепенно увеличивают СCu2+ в растворе.
1. Термодинамическая характеристика процесса в начальный момент (чистая вода).
Идет переход ионов Cu2+ в раствор. Образуется двойной электрический слой со скачком потенциала j на границе. Процесс идет до установления равновесия. Переход из исходного состояния в равновесное идет самопроизвольно и может быть оценен изменением Z (DZ). При Т=const и Р= const  DZ=SmiDni. Реакция Cu®Cu2++2e
DZ=SmiDni. Реакция Cu®Cu2++2e
Здесь SmiDni=mCuo×DnCuo+mCu2+×DnCu2+
Т.к. идет растворение меди, то ×DnCuo<0; DnCu2+>0
Пусть реакция прошла в количестве 1 г-атом. Тогда ×DnCuo=-1; DnCu2=+1 и SmiDni=-mCuo+mCu2+
Однако для обратимых процессов -DZ=А¢пол=nFj, тогда в данном случае получим: -DZ=-(-mCuo+mCu2+= nFj; j=1/nF(mCuo-mCu2+)
Значение j соответствует Dmi – противодействует дальнейшему растворению.
Если увеличить концентрацию железа в растворе (добавка CuSO4), то будет идти увеличение mCu2+, т.к. mi=moi+RT×lnai, при mCuo»const, тогда при некотором СCu2+ наступит момент, когда mCuo-mCu2+=0, т.е mCuo=mCu2+.
В этом случае j=0. Это нулевые растворы.
Согласно Нернсту ЭДС элемента из двух отдельных электродов равна: Е=j1-j2. При этом, если соединить в электрохимических элемент два электрода, находящиеся в нулевых растворах, то ЭДС не будет равна 0. То есть нулевые растворы нельзя рассматривать как растворы с абсолютными нулями потенциалов. (нарушается равенство mСu=mСu2+)
|
|
|
б ) Величина и знак электродного потенциала
Практически потенциалы электродов определяют не в абсолютном виде, т.к. нельзя измерить j отдельного электрода, а относительно некоторого электрода, который принят за стандартный (нормальный). В качестве такого электрода сравнения принят нормальный водородный электрод. (Состоит из черняной платины (подкладка), помещенной в раствор, содержащий ионы Н+ в концентрации ан+=1 г-ион/л. На поверхности платины собирается Н2, давление которого равно 1 ата. На электроде идет реакция окисления-восстановления:
½ Н2 «Н+ + е.
Одна из конструкций водородного электрода выглядит так: Электродный потенциал такого электрода зависит от концентрации ионов водорода в растворе и от давления водорода в газовой фазе. При постоянном давлении РН2=1 ата, и аН+=1, принято Е0Н+=0 при аН+¹1, Ен+=Е0+RT/Flnан+.
Электродным потенциалом (F) данного электрода называется величина, равная его потенциалу по отношению к нормальному водородному электроду.
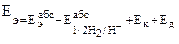 ,
,
где Еэабс – абсолютное значение потенциала электрода; 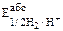 – абсолютное значение водородного электрода; Ек и Ед – контактный потенциал и диффузный потенциал.
– абсолютное значение водородного электрода; Ек и Ед – контактный потенциал и диффузный потенциал.
 2014-02-04
2014-02-04 1897
1897
